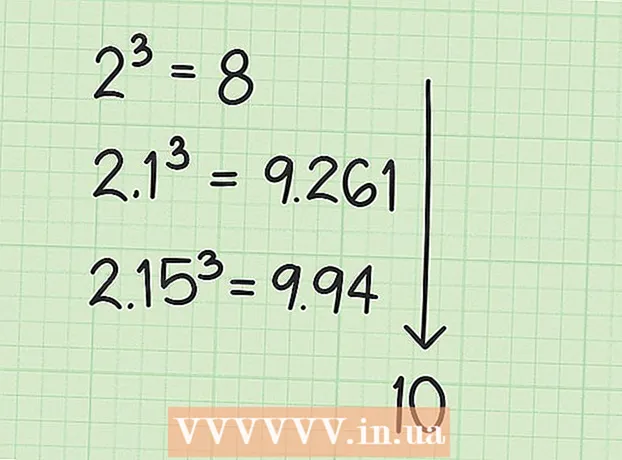Kirjoittaja:
Sara Rhodes
Luomispäivä:
12 Helmikuu 2021
Päivityspäivä:
1 Heinäkuu 2024
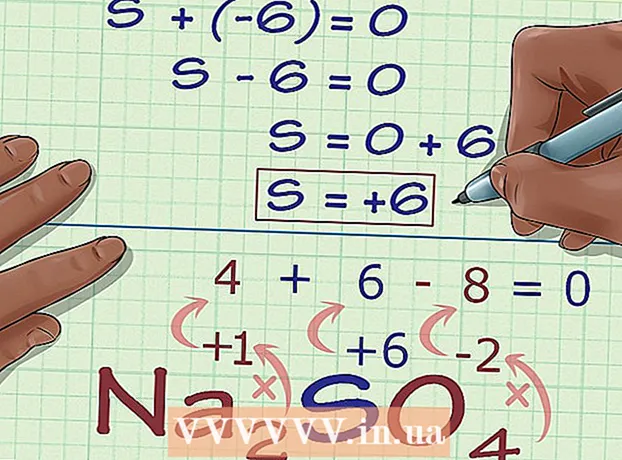
Sisältö
- Askeleet
- Osa 1 /2: Hapettumistilan määrittäminen kemian lakien mukaisesti
- Osa 2/2: Hapettumistilan määrittäminen käyttämättä kemian lakeja
- Vinkkejä
- Mitä tarvitset
Kemiassa termit "hapettuminen" ja "pelkistys" tarkoittavat reaktioita, joissa atomi tai atomiryhmä menettää tai saa elektronit. Hapetustila on yhdelle tai useammalle atomille osoitettu numeerinen arvo, joka kuvaa uudelleenjakautuneiden elektronien lukumäärää ja osoittaa, kuinka nämä elektronit jakautuvat atomien välillä reaktion aikana. Tämän arvon määrittäminen voi olla sekä yksinkertainen että melko monimutkainen toimenpide, riippuen atomeista ja niistä koostuvista molekyyleistä. Lisäksi joidenkin alkuaineiden atomeilla voi olla useita hapettumistiloja. Onneksi hapetustilan määrittämiseen on olemassa yksinkertaisia ja yksiselitteisiä sääntöjä, joiden luottamukselliseen käyttöön riittää kemian ja algebran perusteiden tunteminen.
Askeleet
Osa 1 /2: Hapettumistilan määrittäminen kemian lakien mukaisesti
 1 Selvitä, onko kyseinen aine alkuaine. Kemiallisten yhdisteiden ulkopuolella olevien atomien hapetustila on nolla. Tämä sääntö koskee sekä aineita, jotka on muodostettu erillisistä vapaista atomeista, että aineita, jotka koostuvat kahdesta tai yhden atomin polyatomisesta molekyylistä.
1 Selvitä, onko kyseinen aine alkuaine. Kemiallisten yhdisteiden ulkopuolella olevien atomien hapetustila on nolla. Tämä sääntö koskee sekä aineita, jotka on muodostettu erillisistä vapaista atomeista, että aineita, jotka koostuvat kahdesta tai yhden atomin polyatomisesta molekyylistä. - Esimerkiksi Al(s) ja Cl2 hapetustila on 0, koska molemmat ovat kemiallisesti sitoutumattomia alkuaineita.
- Huomaa, että rikin allotrooppinen muoto S8tai octacera, epätyypillisestä rakenteestaan huolimatta, on myös ominaista nollahapetustila.
 2 Määritä, koostuuko kyseinen aine ioneista. Ionien hapetustila on yhtä suuri kuin niiden varaus. Tämä pätee sekä ilmaisiin ioneihin että niihin, jotka ovat osa kemiallisia yhdisteitä.
2 Määritä, koostuuko kyseinen aine ioneista. Ionien hapetustila on yhtä suuri kuin niiden varaus. Tämä pätee sekä ilmaisiin ioneihin että niihin, jotka ovat osa kemiallisia yhdisteitä. - Esimerkiksi Cl -ionin hapetustila on -1.
- Myös Cl -ionin hapetustila kemiallisessa yhdisteessä NaCl on -1. Koska Na -ionilla on määritelmän mukaan varaus +1, päätämme, että Cl -ionin varaus on -1 ja siten sen hapetustila -1.
 3 Huomaa, että metalli -ioneilla voi olla useita hapettumistiloja. Monien metallielementtien atomit voivat ionisoitua eri määriin. Esimerkiksi metallin, kuten raudan (Fe), ionivaraus on +2 tai +3. Metalli -ionien varaus (ja niiden hapetustila) voidaan määrittää muiden alkuaineiden ionivarauksilla, joiden kanssa tämä metalli on osa kemiallista yhdistettä; tekstissä tämä varaus on merkitty roomalaisilla numeroilla: esimerkiksi raudan (III) hapetustila on +3.
3 Huomaa, että metalli -ioneilla voi olla useita hapettumistiloja. Monien metallielementtien atomit voivat ionisoitua eri määriin. Esimerkiksi metallin, kuten raudan (Fe), ionivaraus on +2 tai +3. Metalli -ionien varaus (ja niiden hapetustila) voidaan määrittää muiden alkuaineiden ionivarauksilla, joiden kanssa tämä metalli on osa kemiallista yhdistettä; tekstissä tämä varaus on merkitty roomalaisilla numeroilla: esimerkiksi raudan (III) hapetustila on +3. - Harkitse esimerkiksi alumiini -ionia sisältävää yhdistettä. AlCl -yhdisteen kokonaisvaraus3 on nolla.Koska tiedämme, että Cl -ioneilla on varaus -1 ja yhdiste sisältää 3 sellaista ionia, kyseessä olevan aineen yleisen neutraalisuuden vuoksi Al -ionin varauksen on oltava +3. Siten tässä tapauksessa alumiinin hapetustila on +3.
 4 Hapen hapetustila on -2 (joitakin poikkeuksia lukuun ottamatta). Lähes kaikissa tapauksissa happiatomien hapetustila on -2. Tästä säännöstä on useita poikkeuksia:
4 Hapen hapetustila on -2 (joitakin poikkeuksia lukuun ottamatta). Lähes kaikissa tapauksissa happiatomien hapetustila on -2. Tästä säännöstä on useita poikkeuksia: - Jos happi on alkuaineessa (O2), sen hapetustila on 0, kuten muiden alkuaineiden tapauksessa.
- Jos happi on osa peroksidi, sen hapetustila on -1. Peroksidit ovat ryhmä yhdisteitä, jotka sisältävät yksinkertaisen happi-happisidoksen (eli peroksidianionin O.2). Esimerkiksi H: n koostumuksessa2O2 (vetyperoksidi) hapen varaus- ja hapetustila on -1.
- Kun happi yhdistetään fluoriin, sen hapetustila on +2, lue alla oleva fluoria koskeva sääntö.
 5 Vedyn hapetustila on +1 muutamaa poikkeusta lukuun ottamatta. Kuten hapen kohdalla, on myös poikkeuksia. Vetyhapetustila on pääsääntöisesti +1 (jos se ei ole alkuaineessa H2). Kuitenkin yhdisteissä, joita kutsutaan hydrideiksi, vedyn hapetustila on -1.
5 Vedyn hapetustila on +1 muutamaa poikkeusta lukuun ottamatta. Kuten hapen kohdalla, on myös poikkeuksia. Vetyhapetustila on pääsääntöisesti +1 (jos se ei ole alkuaineessa H2). Kuitenkin yhdisteissä, joita kutsutaan hydrideiksi, vedyn hapetustila on -1. - Esimerkiksi H: ssa2O Vedyn hapetustila on +1, koska happiatomin varaus on -2 ja kokonaisneutraalisuuteen tarvitaan kaksi +1 varausta. Kuitenkin natriumhydridin koostumuksessa vedyn hapetustila on jo -1, koska Na -ionin varaus on +1, ja yleisen sähköneutraalisuuden kannalta vetyatomin varauksen (ja siten sen hapetustilan) pitäisi olla olla -1.
 6 Fluori aina hapetustila on -1. Kuten jo todettiin, joidenkin alkuaineiden (metalli -ionit, peroksideissa olevat happiatomit jne.) Hapetustila voi vaihdella useista tekijöistä riippuen. Fluorin hapetustila on kuitenkin aina -1. Tämä johtuu siitä, että tällä elementillä on suurin elektronegatiivisuus - toisin sanoen fluoriatomit ovat vähiten halukkaita eroamaan omien elektroniensa kanssa ja houkuttelevat aktiivisimmin vieraita elektroneja. Heidän maksunsa pysyvät siis ennallaan.
6 Fluori aina hapetustila on -1. Kuten jo todettiin, joidenkin alkuaineiden (metalli -ionit, peroksideissa olevat happiatomit jne.) Hapetustila voi vaihdella useista tekijöistä riippuen. Fluorin hapetustila on kuitenkin aina -1. Tämä johtuu siitä, että tällä elementillä on suurin elektronegatiivisuus - toisin sanoen fluoriatomit ovat vähiten halukkaita eroamaan omien elektroniensa kanssa ja houkuttelevat aktiivisimmin vieraita elektroneja. Heidän maksunsa pysyvät siis ennallaan.  7 Yhdisteen hapetustilojen summa on yhtä suuri kuin sen varaus. Kaikkien atomien, jotka muodostavat kemiallisen yhdisteen, hapettumistilojen tulisi lisätä tämän yhdisteen varausta. Esimerkiksi jos yhdiste on neutraali, kaikkien sen atomien hapetustilojen summan tulisi olla nolla; jos yhdiste on polyatominen ioni, jonka varaus on -1, hapetustilojen summa on -1 ja niin edelleen.
7 Yhdisteen hapetustilojen summa on yhtä suuri kuin sen varaus. Kaikkien atomien, jotka muodostavat kemiallisen yhdisteen, hapettumistilojen tulisi lisätä tämän yhdisteen varausta. Esimerkiksi jos yhdiste on neutraali, kaikkien sen atomien hapetustilojen summan tulisi olla nolla; jos yhdiste on polyatominen ioni, jonka varaus on -1, hapetustilojen summa on -1 ja niin edelleen. - Tämä on hyvä testimenetelmä - jos hapetustilojen summa ei ole sama kuin yhdisteen kokonaisvaraus, olet jossain väärässä.
Osa 2/2: Hapettumistilan määrittäminen käyttämättä kemian lakeja
 1 Etsi atomit, joilla ei ole tiukkoja sääntöjä niiden hapettumistilasta. Joillekin elementeille ei ole olemassa vakiintuneita sääntöjä hapetustilan löytämiseksi. Jos atomi ei sovi mihinkään yllä luetelluista säännöistä etkä tiedä sen varausta (esimerkiksi atomi on osa kompleksia ja sen varausta ei ole määritetty), voit määrittää tällaisen atomin hapetustilan poissulkemisen kautta. Määritä ensin kaikkien muiden atomien varaus yhdisteessä ja laske sitten tämän atomin hapetustila yhdisteen tunnetun kokonaisvarauksen perusteella.
1 Etsi atomit, joilla ei ole tiukkoja sääntöjä niiden hapettumistilasta. Joillekin elementeille ei ole olemassa vakiintuneita sääntöjä hapetustilan löytämiseksi. Jos atomi ei sovi mihinkään yllä luetelluista säännöistä etkä tiedä sen varausta (esimerkiksi atomi on osa kompleksia ja sen varausta ei ole määritetty), voit määrittää tällaisen atomin hapetustilan poissulkemisen kautta. Määritä ensin kaikkien muiden atomien varaus yhdisteessä ja laske sitten tämän atomin hapetustila yhdisteen tunnetun kokonaisvarauksen perusteella. - Esimerkiksi yhdisteessä Na2NIIN4 rikkiatomin (S) varaus on tuntematon - tiedämme vain, että se ei ole nolla, koska rikki ei ole alkuaineessa. Tämä yhdiste toimii hyvänä esimerkkinä havainnollistamaan algebrallista menetelmää hapetustilan määrittämiseksi.
 2 Etsi yhdisteen jäljellä olevien alkuaineiden hapetustilat. Määritä yhdisteen jäljellä olevien atomien hapetustilat käyttämällä edellä kuvattuja sääntöjä. Älä unohda poikkeuksia sääntöön O, H ja niin edelleen.
2 Etsi yhdisteen jäljellä olevien alkuaineiden hapetustilat. Määritä yhdisteen jäljellä olevien atomien hapetustilat käyttämällä edellä kuvattuja sääntöjä. Älä unohda poikkeuksia sääntöön O, H ja niin edelleen. - Na: n puolesta2NIIN4sääntöjämme käyttämällä havaitsemme, että Na -ionin varaus (ja siten hapetustila) on +1 ja kullekin happiatomille se on -2.
 3 Kerro atomien lukumäärä niiden hapetustilalla. Nyt kun tiedämme kaikkien atomien paitsi yhden hapetustilan, on otettava huomioon, että joidenkin alkuaineiden atomit voivat olla useita. Kerro kunkin elementin atomien lukumäärä (se on ilmoitettu yhdisteen kemiallisessa kaavassa alaindeksinä elementin symbolin jälkeen) sen hapetustilalla.
3 Kerro atomien lukumäärä niiden hapetustilalla. Nyt kun tiedämme kaikkien atomien paitsi yhden hapetustilan, on otettava huomioon, että joidenkin alkuaineiden atomit voivat olla useita. Kerro kunkin elementin atomien lukumäärä (se on ilmoitettu yhdisteen kemiallisessa kaavassa alaindeksinä elementin symbolin jälkeen) sen hapetustilalla. - Na2NIIN4 meillä on 2 Na -atomia ja 4 O. Näin ollen kertomalla 2 × +1, saamme kaikkien Na -atomien hapetustilan (2) ja kertomalla 4 × -2 -O (-8) -atomien hapetustilan.
 4 Yhdistä aiemmat tulokset. Yhteenvetona kertomisen tuloksista saadaan yhdisteen hapetustila ilman ottaen huomioon halutun atomin panoksen.
4 Yhdistä aiemmat tulokset. Yhteenvetona kertomisen tuloksista saadaan yhdisteen hapetustila ilman ottaen huomioon halutun atomin panoksen. - Esimerkissämme Na2NIIN4 lisäämme 2 ja -8 ja saamme -6.
 5 Etsi tuntematon hapetustila yhdisteen varauksesta. Sinulla on nyt kaikki tiedot halutun hapetustilan laskemiseksi helposti. Kirjoita yhtälö, jonka vasemmalla puolella on edellisessä laskentavaiheessa saadun luvun ja tuntemattoman hapetustilan summa ja yhdisteen kokonaisvarauksen oikea puoli. Toisin sanoen, (Tunnettujen hapetustilojen summa) + (haluttu hapetustila) = (yhdisteen varaus).
5 Etsi tuntematon hapetustila yhdisteen varauksesta. Sinulla on nyt kaikki tiedot halutun hapetustilan laskemiseksi helposti. Kirjoita yhtälö, jonka vasemmalla puolella on edellisessä laskentavaiheessa saadun luvun ja tuntemattoman hapetustilan summa ja yhdisteen kokonaisvarauksen oikea puoli. Toisin sanoen, (Tunnettujen hapetustilojen summa) + (haluttu hapetustila) = (yhdisteen varaus).- Meidän tapauksessamme Na2NIIN4 ratkaisu näyttää tältä:
- (Tunnettujen hapetustilojen summa) + (haluttu hapetustila) = (yhdistelmävaraus)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2NIIN4 rikki on hapetustilassa 6.
- Meidän tapauksessamme Na2NIIN4 ratkaisu näyttää tältä:
Vinkkejä
- Yhdisteissä kaikkien hapetustilojen summan on vastattava varausta. Jos yhdiste on esimerkiksi kaksiatomi -ioni, atomien hapetustilojen summan on vastattava ionin kokonaisvarausta.
- On erittäin hyödyllistä pystyä käyttämään jaksottaista taulukkoa ja tietää, missä metalliset ja ei-metalliset elementit siinä sijaitsevat.
- Alkuaineiden atomien hapetustila on aina nolla. Yhden ionin hapetustila on yhtä suuri kuin sen varaus. Jaksollisen taulukon ryhmän 1A elementeillä, kuten vety, litium, natrium, alkuaineessa on hapetustila +1; Ryhmän 2A metallien, kuten magnesiumin ja kalsiumin, hapetustila on +2 alkuaineessa. Hapella ja vedyllä voi kemiallisen sidoksen tyypistä riippuen olla 2 erilaista hapetustilaa.
Mitä tarvitset
- Elementtien jaksollinen taulukko
- Internet -yhteys tai kemian viitekirjat
- Arkki paperia, kynä tai lyijykynä
- Laskin