Kirjoittaja:
Janice Evans
Luomispäivä:
25 Heinäkuu 2021
Päivityspäivä:
1 Heinäkuu 2024
Sisältö
Ioniyhtälöt ovat olennainen osa kemiaa. Ne sisältävät vain niitä komponentteja, jotka muuttuvat kemiallisen reaktion aikana. Useimmiten ioniyhtälöitä käytetään kuvaamaan redoksireaktioita, vaihto- ja neutralointireaktioita.Ioniyhtälön kirjoittaminen vaatii kolme perusvaihetta: tasapainottaa kemiallisen reaktion molekyyliyhtälön, muuntaa sen täydelliseksi ioniyhtälöksi (eli kirjoittaa komponentit sellaisina kuin ne ovat liuoksessa) ja lopuksi kirjoittaa lyhyt ioniyhtälö.
Askeleet
Osa 1/2: Ionin yhtälön komponentit
 1 Ymmärrä ero molekyylin ja ioniset yhdisteet. Ioniyhtälön kirjoittamiseksi ensimmäinen askel on määrittää reaktioon osallistuvat ioniset yhdisteet. Ioniset aineet ovat niitä, jotka hajoavat (hajoavat) varautuneiksi ioneiksi vesiliuoksissa. Molekyyliyhdisteet eivät hajoa ioneiksi. Ne koostuvat kahdesta ei-metallisesta elementistä, ja niitä kutsutaan joskus kovalenttisiksi yhdisteiksi.
1 Ymmärrä ero molekyylin ja ioniset yhdisteet. Ioniyhtälön kirjoittamiseksi ensimmäinen askel on määrittää reaktioon osallistuvat ioniset yhdisteet. Ioniset aineet ovat niitä, jotka hajoavat (hajoavat) varautuneiksi ioneiksi vesiliuoksissa. Molekyyliyhdisteet eivät hajoa ioneiksi. Ne koostuvat kahdesta ei-metallisesta elementistä, ja niitä kutsutaan joskus kovalenttisiksi yhdisteiksi. - Ioniyhdisteitä voi esiintyä metallin ja ei-metalli-, metalli- ja polyatomi-ionien tai useiden polyatomisten ionien välillä.
- Jos olet epävarma siitä, mihin ryhmään tietty yhdiste kuuluu, katso sen ainesosien ominaisuuksia jaksollisesta taulukosta.
 2 Määritä yhdisteen liukoisuus. Kaikki ioniset yhdisteet eivät liukene vesiliuoksiin, eli kaikki eivät hajoa erillisiksi ioneiksi. Ennen kuin aloitat yhtälön kirjoittamisen, sinun on löydettävä kunkin yhdisteen liukoisuus. Alla on lyhyet säännöt liukoisuudesta. Tarkemmat säännöt ja poikkeukset sääntöön löytyvät liukenemistaulukosta.
2 Määritä yhdisteen liukoisuus. Kaikki ioniset yhdisteet eivät liukene vesiliuoksiin, eli kaikki eivät hajoa erillisiksi ioneiksi. Ennen kuin aloitat yhtälön kirjoittamisen, sinun on löydettävä kunkin yhdisteen liukoisuus. Alla on lyhyet säännöt liukoisuudesta. Tarkemmat säännöt ja poikkeukset sääntöön löytyvät liukenemistaulukosta. - Noudata sääntöjä seuraavassa järjestyksessä:
- kaikki suolat Na, K ja NH4 liuottaa;
- kaikki suolat EI3, C.2H3O2, ClO3 ja ClO4 liukeneva;
- kaikki suolat Ag, Pb ja Hg2 liukenematon;
- kaikki Cl-, Br- ja I -suolat liukenevat;
- suolat CO3, O, S, OH, PO4, CrO4, Cr2O7 ja niin3 liukenematon (joitakin poikkeuksia lukuun ottamatta);
- SO suoloja4 liukoinen (joitakin poikkeuksia lukuun ottamatta).
 3 Määritä yhdisteen kationi ja anioni. Positiivisesti varautuneita ioneja (yleensä metalleja) kutsutaan kationeiksi. Anioneilla on negatiivinen varaus, yleensä ei-metalli-ioneilla. Jotkut ei-metallit voivat muodostaa anionien lisäksi myös kationeja, kun taas metalliatomit toimivat aina kationeina.
3 Määritä yhdisteen kationi ja anioni. Positiivisesti varautuneita ioneja (yleensä metalleja) kutsutaan kationeiksi. Anioneilla on negatiivinen varaus, yleensä ei-metalli-ioneilla. Jotkut ei-metallit voivat muodostaa anionien lisäksi myös kationeja, kun taas metalliatomit toimivat aina kationeina. - Esimerkiksi yhdisteessä NaCl (ruokasuola) Na on positiivisesti varautunut kationi, koska se on metalli ja Cl on negatiivisesti varautunut anioni, koska se on ei-metalli.
 4 Määritä reaktioon osallistuvat polyatomiset (kompleksiset) ionit. Tällaiset ionit ovat varautuneita molekyylejä, joiden atomien välillä on niin vahva sidos, että ne eivät hajoa kemiallisissa reaktioissa. On tarpeen tunnistaa polyatomiset ionit, koska niillä on oma varauksensa eivätkä ne hajoa yksittäisiksi atomeiksi. Polyatomisilla ioneilla voi olla sekä positiivisia että negatiivisia varauksia.
4 Määritä reaktioon osallistuvat polyatomiset (kompleksiset) ionit. Tällaiset ionit ovat varautuneita molekyylejä, joiden atomien välillä on niin vahva sidos, että ne eivät hajoa kemiallisissa reaktioissa. On tarpeen tunnistaa polyatomiset ionit, koska niillä on oma varauksensa eivätkä ne hajoa yksittäisiksi atomeiksi. Polyatomisilla ioneilla voi olla sekä positiivisia että negatiivisia varauksia. - Yleisellä kemiakurssilla sinun on todennäköisesti muistettava joitakin yleisimpiä moniatomisia ioneja.
- Yleisimmät polyatomiset ionit ovat CO3, EI3, EI2, Niin4, Niin3, ClO4 ja ClO3.
- On monia muita polyatomisia ioneja, jotka löytyvät kemian oppikirjasta tai Internetistä.
Osa 2/2: Ioniyhtälöiden kirjoittaminen
 1 Tasapainota täydellinen molekyyliyhtälö. Ennen kuin aloitat ioniyhtälön kirjoittamisen, sinun on tasapainotettava alkuperäinen molekyyliyhtälö. Tätä varten on tarpeen sijoittaa vastaavat kertoimet yhdisteiden eteen niin, että kunkin elementin atomien määrä vasemmalla puolella on yhtä suuri kuin niiden lukumäärä yhtälön oikealla puolella.
1 Tasapainota täydellinen molekyyliyhtälö. Ennen kuin aloitat ioniyhtälön kirjoittamisen, sinun on tasapainotettava alkuperäinen molekyyliyhtälö. Tätä varten on tarpeen sijoittaa vastaavat kertoimet yhdisteiden eteen niin, että kunkin elementin atomien määrä vasemmalla puolella on yhtä suuri kuin niiden lukumäärä yhtälön oikealla puolella. - Kirjoita kunkin elementin atomien lukumäärä yhtälön kummallekin puolelle.
- Lisää kertoimet alkuaineiden eteen (paitsi happi ja vety) niin, että yhtälön vasemman ja oikean puolen kunkin elementin atomien määrä on sama.
- Tasapainottaa vetyatomeja.
- Tasapainota happiatomit.
- Laske kunkin elementin atomien lukumäärä yhtälön kummallakin puolella ja varmista, että se on sama.
- Esimerkiksi Cr + NiCl -yhtälön tasapainottamisen jälkeen2 -> CrCl3 + Ni saamme 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
 2 Määritä jokaisen reaktioon osallistuvan aineen tila. Tämän voi usein arvioida ongelman tilan perusteella. Tietyt säännöt auttavat määrittämään, missä tilassa elementti tai yhteys on.
2 Määritä jokaisen reaktioon osallistuvan aineen tila. Tämän voi usein arvioida ongelman tilan perusteella. Tietyt säännöt auttavat määrittämään, missä tilassa elementti tai yhteys on. - Jos tietyn elementin tilaa ei ilmoiteta ongelman tilassa, määritä se jaksollisen taulukon avulla.
- Jos ehto sanoo, että yhdiste on liuoksessa, merkitse se (rr).
- Jos yhtälö sisältää vettä, määritä liukoisuustaulukon avulla, hajoaako ioniyhdiste. Korkean liukoisuuden tapauksessa yhdiste hajoaa veteen (rr). Jos yhdisteen liukoisuus on heikko, se pysyy kiinteänä (TV).
- Jos vesi ei osallistu reaktioon, ioniyhdiste pysyy kiinteässä muodossa (TV).
- Jos ongelmassa esiintyy happoa tai emästä, ne liuotetaan veteen (rr).
- Tarkastellaan esimerkiksi reaktiota 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Puhtaassa muodossa alkuaineet Cr ja Ni ovat kiinteässä faasissa. NiCl2 ja CrCl3 ovat liukoisia ionisia yhdisteitä, eli ne ovat liuoksessa. Näin ollen tämä yhtälö voidaan kirjoittaa uudelleen seuraavasti: 2Cr(TV) + 3NiCl2(rr) -> 2CrCl3(rr) + 3Ni(TV).
 3 Määritä, mitkä yhdisteet dissosioituvat (erottuvat kationeiksi ja anioneiksi) liuoksessa. Hajoamisen jälkeen yhdiste hajoaa positiivisiksi (kationiksi) ja negatiivisiksi (anioniksi) komponenteiksi. Nämä komponentit siirtyvät sitten kemiallisen reaktion ioniyhtälöön.
3 Määritä, mitkä yhdisteet dissosioituvat (erottuvat kationeiksi ja anioneiksi) liuoksessa. Hajoamisen jälkeen yhdiste hajoaa positiivisiksi (kationiksi) ja negatiivisiksi (anioniksi) komponenteiksi. Nämä komponentit siirtyvät sitten kemiallisen reaktion ioniyhtälöön. - Kiinteät aineet, nesteet, kaasut, molekyyliyhdisteet, ioniliuokset, joiden liukoisuus on heikko, polyatomiset ionit ja heikot hapot eivät hajoa.
- Erottaa täysin hyvin liukoiset ioniset yhdisteet (käytä liukoisuustaulukkoa) ja vahvat hapot (HCl)(rr), HBr(rr), HEI(rr), H2NIIN4(rr), HClO4(rr) ja HNO3(rr)).
- Huomaa, että vaikka polyatomiset ionit eivät hajoa, ne voidaan sisällyttää ioniyhdisteeseen ja erottaa siitä liuoksessa.
 4 Laske kunkin dissosioituneen ionin varaus. Muista tällöin, että metallit muodostavat positiivisesti varautuneita kationeja ja ei-metalliatomit muuttuvat negatiivisiksi anioneiksi. Määritä alkuaineiden varaukset jaksollisen taulukon mukaisesti. On myös tarpeen tasapainottaa kaikki varaukset neutraaleissa yhdisteissä.
4 Laske kunkin dissosioituneen ionin varaus. Muista tällöin, että metallit muodostavat positiivisesti varautuneita kationeja ja ei-metalliatomit muuttuvat negatiivisiksi anioneiksi. Määritä alkuaineiden varaukset jaksollisen taulukon mukaisesti. On myös tarpeen tasapainottaa kaikki varaukset neutraaleissa yhdisteissä. - Yllä olevassa esimerkissä NiCl2 hajoaa Ni: ksi ja Cl: ksi ja CrCl: ksi3 hajoaa Cr: ksi ja Cl: ksi.
- Nikkeli -ionilla on 2+ varaus, koska se on sitoutunut kahteen kloori -ioniin, joista jokaisella on yksi negatiivinen varaus. Tässä tapauksessa yhden Ni -ionin on tasapainotettava kaksi negatiivisesti varautunutta Cl -ionia. Cr -ionilla on 3+ varaus, koska sen on neutraloitava kolme negatiivisesti varautunutta Cl -ionia.
- Muista, että polyatomisilla ioneilla on omat varauksensa.
 5 Kirjoita yhtälö uudelleen niin, että kaikki liukoiset yhdisteet erotetaan yksittäisiksi ioneiksi. Kaikki mikä hajoaa tai ionisoituu (kuten vahvat hapot), hajoaa kahteen erilliseen ioniin. Tässä tapauksessa aine pysyy liuenneessa tilassa (rr). Tarkista, että yhtälö on tasapainossa.
5 Kirjoita yhtälö uudelleen niin, että kaikki liukoiset yhdisteet erotetaan yksittäisiksi ioneiksi. Kaikki mikä hajoaa tai ionisoituu (kuten vahvat hapot), hajoaa kahteen erilliseen ioniin. Tässä tapauksessa aine pysyy liuenneessa tilassa (rr). Tarkista, että yhtälö on tasapainossa. - Kiinteät aineet, nesteet, kaasut, heikot hapot ja heikosti liukoiset ioniset yhdisteet eivät muuta tilaa ja eivät jakaudu ioneiksi. Jätä heidät sellaisiksi kuin olivat.
- Molekyyliyhdisteet yksinkertaisesti hajaantuvat liuokseen ja niiden tila muuttuu liuenneiksi (rr). On kolme molekyyliyhdistettä, jotka ei menee valtioon (rr), tämä on CH4(G), C.3H8(G) ja C8H18(f).
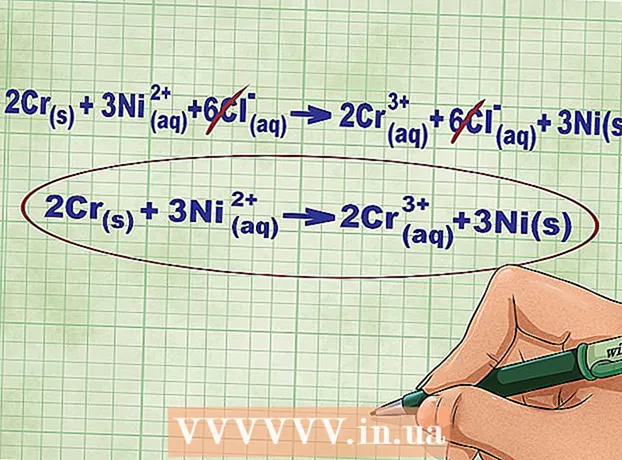
- Tarkasteltavana olevaa reaktiota varten täydellinen ioniyhtälö voidaan kirjoittaa seuraavassa muodossa: 2Cr(TV) + 3Ni(rr) + 6Cl(rr) -> 2 Kr(rr) + 6Cl(rr) + 3Ni(TV)... Jos kloori ei ole osa yhdistettä, se hajoaa yksittäisiksi atomeiksi, joten kerroimme Cl -ionien lukumäärän 6: lla yhtälön molemmilla puolilla.
 6 Peruuta yhtälön vasemmalla ja oikealla puolella olevat yhtä suuret ionit. Voit yliviivata vain ne ionit, jotka ovat täysin identtisiä yhtälön molemmin puolin (joilla on samat varaukset, alaindeksit jne.). Kirjoita yhtälö uudelleen ilman näitä ioneja.
6 Peruuta yhtälön vasemmalla ja oikealla puolella olevat yhtä suuret ionit. Voit yliviivata vain ne ionit, jotka ovat täysin identtisiä yhtälön molemmin puolin (joilla on samat varaukset, alaindeksit jne.). Kirjoita yhtälö uudelleen ilman näitä ioneja. - Esimerkissämme yhtälön molemmat puolet sisältävät 6 Cl -ionia, jotka voidaan ylittää. Näin saamme lyhyen ioniyhtälön: 2Cr(TV) + 3Ni(rr) -> 2 Kr(rr) + 3Ni(TV).
- Tarkista tulos. Ioniyhtälön vasemman ja oikean puolen kokonaisvarausten on oltava yhtä suuret.
Vinkkejä
- Harjoita itseäsi aina kirjoita muistiin kaikkien komponenttien aggregaatiotila kaikissa kemiallisten reaktioiden yhtälöissä.