Kirjoittaja:
Virginia Floyd
Luomispäivä:
6 Elokuu 2021
Päivityspäivä:
1 Heinäkuu 2024

Sisältö
- Askeleet
- Menetelmä 1/3: Perusteet
- Menetelmä 2/3: Sidoksen tyypin määrittäminen elektronegatiivisuuden avulla
- Menetelmä 3/3: Mulliken -elektronegatiivisuuden laskeminen
- Vinkkejä
Kemia, elektronegatiivisuus on atomien kyky houkutella elektroneja muista atomeista niihin. Atomi, jolla on suuri elektronegatiivisuus, vetää elektroneja voimakkaasti ja atomi, jolla on alhainen elektronegatiivisuus, houkuttelee elektroneja heikosti. Elektronegatiivisuusarvoja käytetään ennustamaan eri atomien käyttäytymistä kemiallisissa yhdisteissä.
Askeleet
Menetelmä 1/3: Perusteet
 1 Kemialliset sidokset. Tällaiset sidokset syntyvät, kun atomien elektronit ovat vuorovaikutuksessa keskenään, eli kaksi elektronia (yksi kustakin atomista) tulee yleiseksi.
1 Kemialliset sidokset. Tällaiset sidokset syntyvät, kun atomien elektronit ovat vuorovaikutuksessa keskenään, eli kaksi elektronia (yksi kustakin atomista) tulee yleiseksi. - Kuvaus syistä atomien elektronien vuorovaikutukselle ei kuulu tämän artikkelin soveltamisalaan.Jos haluat lisätietoja tästä aiheesta, lue esimerkiksi tämä artikkeli.
 2 Elektronegatiivisuuden vaikutus. Kun kaksi atomia vetää toistensa elektroneja, vetovoima ei ole sama. Atomi, jolla on suurempi elektronegatiivisuus, houkuttelee kahta elektronia voimakkaammin. Atomi, jolla on erittäin suuri elektronegatiivisuus, houkuttelee elektroneja niin voimakkaasti, että emme enää puhu jaetuista elektroneista.
2 Elektronegatiivisuuden vaikutus. Kun kaksi atomia vetää toistensa elektroneja, vetovoima ei ole sama. Atomi, jolla on suurempi elektronegatiivisuus, houkuttelee kahta elektronia voimakkaammin. Atomi, jolla on erittäin suuri elektronegatiivisuus, houkuttelee elektroneja niin voimakkaasti, että emme enää puhu jaetuista elektroneista. - Esimerkiksi NaCl -molekyylissä (natriumkloridi, tavallinen suola) klooriatomilla on melko korkea elektronegatiivisuus ja natriumatomi on melko alhainen. Siis elektronit vetävät puoleensa klooriatomi ja hylkivät natriumiatomeja.
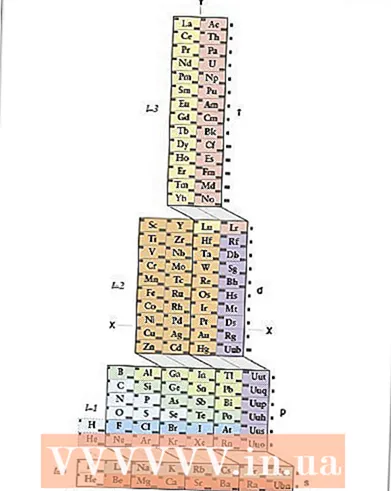
 3 Elektronegatiivisuustaulukko. Tämä taulukko sisältää kemialliset elementit, jotka on järjestetty samalla tavalla kuin jaksollisessa taulukossa, mutta jokaiselle alkuaineelle on annettu sen atomien elektronegatiivisuus. Tällainen taulukko löytyy kemian oppikirjoista, viitemateriaaleista ja verkosta.
3 Elektronegatiivisuustaulukko. Tämä taulukko sisältää kemialliset elementit, jotka on järjestetty samalla tavalla kuin jaksollisessa taulukossa, mutta jokaiselle alkuaineelle on annettu sen atomien elektronegatiivisuus. Tällainen taulukko löytyy kemian oppikirjoista, viitemateriaaleista ja verkosta. - Täältä löydät erinomaisen elektronegatiivisuustaulukon. Huomaa, että se käyttää Paulingin elektronegatiivisuusasteikkoa, joka on yleisin. On kuitenkin olemassa muita tapoja laskea elektronegatiivisuus, joista yksi käsitellään alla.
 4 Elektronegatiivisuustrendit. Jos sinulla ei ole elektronegatiivisuustaulukkoa, voit arvioida atomin elektronegatiivisuuden jaksollisen taulukon elementin sijainnin perusteella.
4 Elektronegatiivisuustrendit. Jos sinulla ei ole elektronegatiivisuustaulukkoa, voit arvioida atomin elektronegatiivisuuden jaksollisen taulukon elementin sijainnin perusteella. - Miten oikealle elementti sijaitsee, lisää atomin elektronegatiivisuus.
- Miten korkeampi elementti sijaitsee, lisää atomin elektronegatiivisuus.
- Siten jaksollisen järjestelmän oikeassa yläkulmassa olevien elementtien atomit ovat suurimmat elektronegatiivisuudet ja vasemmassa alakulmassa olevien elementtien atomit ovat pienimmät.
- NaCl -esimerkissämme voimme sanoa, että kloorilla on suurempi elektronegatiivisuus kuin natriumilla, koska kloori sijaitsee natriumin oikealla puolella.
Menetelmä 2/3: Sidoksen tyypin määrittäminen elektronegatiivisuuden avulla
 1 Laske ero kahden atomin elektronegatiivisuuksien välillä ymmärtääksesi niiden välisen sidoksen ominaisuudet. Tätä varten vähennä pienempi elektronegatiivisuus suuremmasta.
1 Laske ero kahden atomin elektronegatiivisuuksien välillä ymmärtääksesi niiden välisen sidoksen ominaisuudet. Tätä varten vähennä pienempi elektronegatiivisuus suuremmasta. - Harkitse esimerkiksi HF -molekyyliä. Vähennä vedyn (2.1) elektronegatiivisuus fluorin (4.0) elektronegatiivisuudesta: 4.0 - 2.1 = 1,9.
 2 Jos ero on pienempi kuin 0,5, sidos on kovalenttinen ei-polaarinen, jossa elektronit vetävät puoleensa lähes samalla lujuudella. Tällaiset sidokset muodostuvat kahden identtisen atomin välille. Ei-polaarisia yhteyksiä on yleensä erittäin vaikea katkaista. Tämä johtuu siitä, että atomit jakavat elektroneja, mikä tekee niiden sidoksesta vakaan. Sen tuhoaminen vaatii paljon energiaa.
2 Jos ero on pienempi kuin 0,5, sidos on kovalenttinen ei-polaarinen, jossa elektronit vetävät puoleensa lähes samalla lujuudella. Tällaiset sidokset muodostuvat kahden identtisen atomin välille. Ei-polaarisia yhteyksiä on yleensä erittäin vaikea katkaista. Tämä johtuu siitä, että atomit jakavat elektroneja, mikä tekee niiden sidoksesta vakaan. Sen tuhoaminen vaatii paljon energiaa. - Esimerkiksi molekyyli O2 on tämän tyyppinen liitäntä. Koska kahdella happiatomilla on sama elektronegatiivisuus, ero niiden välillä on 0.
 3 Jos ero on alueella 0,5 - 1,6, sidos on kovalenttinen polaarinen. Tässä tapauksessa toinen kahdesta atomista houkuttelee elektroneja voimakkaammin ja saa siten osittaisen negatiivisen varauksen ja toinen osittaisen positiivisen varauksen. Tämä varauksen epätasapaino sallii molekyylin osallistua tiettyihin reaktioihin.
3 Jos ero on alueella 0,5 - 1,6, sidos on kovalenttinen polaarinen. Tässä tapauksessa toinen kahdesta atomista houkuttelee elektroneja voimakkaammin ja saa siten osittaisen negatiivisen varauksen ja toinen osittaisen positiivisen varauksen. Tämä varauksen epätasapaino sallii molekyylin osallistua tiettyihin reaktioihin. - Esimerkiksi molekyyli H2O (vedellä) on tämäntyyppinen sidos. O -atomi on elektronegatiivisempi kuin kaksi H -atomia, joten happi houkuttelee elektroneja voimakkaammin ja saa osittaisen negatiivisen varauksen ja vety - osittaisen positiivisen varauksen.
 4 Jos ero on suurempi kuin 2,0, sidos on ioninen. Tämä on sidos, jossa yhteinen elektronipari kulkee pääasiassa atomille, jolla on suurempi elektronegatiivisuus, joka saa negatiivisen varauksen, ja atomi, jolla on pienempi elektronegatiivisuus, positiivisen varauksen. Molekyylit, joilla on tällaiset sidokset, reagoivat hyvin muiden atomien kanssa ja jopa polaariset atomit voivat tuhota ne.
4 Jos ero on suurempi kuin 2,0, sidos on ioninen. Tämä on sidos, jossa yhteinen elektronipari kulkee pääasiassa atomille, jolla on suurempi elektronegatiivisuus, joka saa negatiivisen varauksen, ja atomi, jolla on pienempi elektronegatiivisuus, positiivisen varauksen. Molekyylit, joilla on tällaiset sidokset, reagoivat hyvin muiden atomien kanssa ja jopa polaariset atomit voivat tuhota ne. - Esimerkiksi NaCl (natriumkloridi) -molekyylillä on tämäntyyppinen sidos.Klooriatomi on niin elektronegatiivinen, että se vetää puoleensa molemmat elektronit ja saa negatiivisen varauksen, ja natriumiatomi saa positiivisen varauksen.
- NaCl voidaan tuhota polaarisella molekyylillä, kuten H20 (vesi). Vesimolekyylissä molekyylin vetypuoli on positiivinen ja happipuoli negatiivinen. Jos sekoitat suolaa veteen, vesimolekyylit hajottavat suolamolekyylit ja aiheuttavat sen liukenemisen.
 5 Jos ero on 1,6 ja 2,0, tarkista metalli. Jos molekyylissä on metalliatomi, sidos on ioninen. Jos molekyylissä ei ole metalliatomeja, sidos on polaarinen kovalentti.
5 Jos ero on 1,6 ja 2,0, tarkista metalli. Jos molekyylissä on metalliatomi, sidos on ioninen. Jos molekyylissä ei ole metalliatomeja, sidos on polaarinen kovalentti. - Metallit sijaitsevat jaksollisen taulukon vasemmalla puolella ja keskellä. Tässä taulukossa metallit on korostettu.
- HF -esimerkissämme elektronegatiivisuuksien ero on tällä alueella. Koska H ja F eivät ole metalleja, sidos napainen kovalentti.
Menetelmä 3/3: Mulliken -elektronegatiivisuuden laskeminen
 1 Etsi atomin ensimmäinen ionisaatioenergia. Mullikenin elektronegatiivisuusasteikko on hieman erilainen kuin edellä mainittu Paulingin asteikko. Ensimmäinen ionisaatioenergia tarvitaan yhden atomin poistamiseksi elektronista.
1 Etsi atomin ensimmäinen ionisaatioenergia. Mullikenin elektronegatiivisuusasteikko on hieman erilainen kuin edellä mainittu Paulingin asteikko. Ensimmäinen ionisaatioenergia tarvitaan yhden atomin poistamiseksi elektronista. - Tällaisen energian merkitys löytyy esimerkiksi kemian viitekirjoista tai verkosta, esimerkiksi täältä.
- Otetaan esimerkiksi litiumin (Li) elektronegatiivisuus. Sen ensimmäinen ionisaatioenergia on 520 kJ / mol.
 2 Etsi affiniteetin energia elektroniin. Tämä on energiaa, joka vapautuu elektronin kiinnittämisprosessissa atomiin. Tällaisen energian merkitys löytyy esimerkiksi kemian viitekirjoista tai verkosta, esimerkiksi täältä.
2 Etsi affiniteetin energia elektroniin. Tämä on energiaa, joka vapautuu elektronin kiinnittämisprosessissa atomiin. Tällaisen energian merkitys löytyy esimerkiksi kemian viitekirjoista tai verkosta, esimerkiksi täältä. - Litiumin elektroni -affiniteettienergia on 60 kJ / mol.
 3 Käytä Mullikenin elektronegatiivisuusyhtälöä:RUMulliken = (1,97 × 10) (Ei+ Eea) + 0,19.
3 Käytä Mullikenin elektronegatiivisuusyhtälöä:RUMulliken = (1,97 × 10) (Ei+ Eea) + 0,19. - Esimerkissämme:
- RUMulliken = (1,97 × 10) (Ei+ Eea) + 0,19
- RUMulliken = (1,97×10)(520 + 60) + 0,19
- RUMulliken = 1,143 + 0,19 = 1,333
- Esimerkissämme:
Vinkkejä
- Pauling- ja Mulliken-asteikon lisäksi on olemassa Allone-Rochow'n, Sandersonin ja Allenin mukaisia elektronegatiivisuusasteikkoja. Niillä kaikilla on omat kaavansa elektronegatiivisuuden laskemiseen (jotkut niistä ovat melko monimutkaisia).
- Elektronegatiivisuudella ei ole mittayksiköitä.