Kirjoittaja:
Lewis Jackson
Luomispäivä:
12 Saattaa 2021
Päivityspäivä:
1 Heinäkuu 2024
Sisältö
Neutronien määrän määrittäminen atomissa on melko yksinkertaista, sinun ei tarvitse edes tehdä mitään kokeita. Tavallisen atomin tai isotoopin neutronien määrän laskemiseksi tarvitset vain jaksollisen taulukon ja noudata ohjeita.
Askeleet
Menetelmä 1/2: Etsi neutronien lukumäärä normaalista atomista
Määritä elementin sijainti jaksollisessa taulukossa. Esimerkiksi elementti osmium (Os) löytyy kuudennesta rivistä ylhäältä.

Etsi elementin atominumero. Tämä on kaikkein silmiinpistävin numero, joka kulkee jokaisen elementin ohitse ja on alkusymbolin yläpuolella (käytetyllä taululla ei ole muita numeroita). Atomiluku on protonien lukumäärä kyseisen elementin yhdessä atomissa. Os on luku 76, mikä tarkoittaa, että osmiumatomissa on 76 protonia.- Protonien lukumäärä ei koskaan muutu elementissä; se on lähinnä elementin määrittelevä ominaisuus.

Etsi elementin atomipaino. Tämä numero löytyy yleensä alkusymbolin alapuolelta. Huomaa, että tämän esimerkin jaksollisella taulukolla on vain atominumero eikä atomipaino. Ei kaikki jaksolliset taulukot. Osmiumin atomipaino on 190,23.
Pyöristä atomipaino lähimpään kokonaislukuun saadaksesi atomimassan. Esimerkiksi 190,23 pyöristetään arvoon 190, joten osmiumin atomimassa on 190.- Atomipaino on saman kemiallisen alkuaineen isotooppien keskiarvo, minkä vuoksi se ei yleensä ole kokonaisluku.
Vähennä atomiluku atomimassasta. Koska suurin osa atomimassasta on protonien ja neutronien massa, vähentämällä protonien lukumäärä atomimassasta (ts. Atomiluku), saat Kreivi saat neutronien määrän atomissa. Desimaalipisteen jälkeinen luku edustaa hyvin pientä elektronimassaa atomissa. Tässä esimerkissä meillä on: 190 (massatomi) - 76 (protonien lukumäärä) = 114 (neutronien lukumäärä).
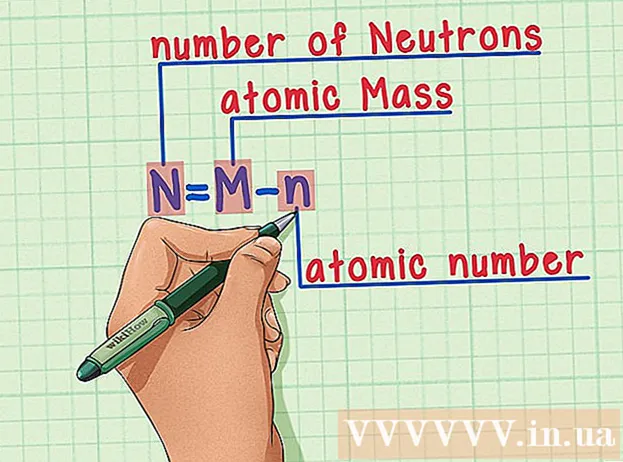
Muista resepti. Neutronien lukumäärän löytämiseksi käytämme yksinkertaisesti seuraavaa kaavaa:
- N = M - n
- N = neutronien lukumäärä
- M = atomimassa
- n = atomiluku
- N = M - n
Menetelmä 2/2: Löydä isotoopin neutronien määrä
Määritä elementin sijainti jaksollisessa taulukossa. Otetaan esimerkkinä hiili-14-isotooppi. Koska hiili-14: n isotooppimuoto on yksinkertaisesti hiili (C), etsi hiiltä jaksollisesta taulukosta (toinen rivi ylhäältä).
Etsi elementin atominumero. Tämä on kaikkein silmiinpistävin numero, joka kulkee jokaisen elementin ohitse ja on alkusymbolin yläpuolella (käytetyllä taululla ei ole muita numeroita). Atomiluku on protonien lukumäärä kyseisen elementin yhdessä atomissa. C on numero 6, mikä tarkoittaa, että hiiliatomissa on 6 protonia.
Etsi atomimassa. Tämä on erittäin helppoa isotooppien kanssa, koska ne on nimetty atomimassan mukaan. Esimerkiksi hiili-14: n atomimassa olisi 14. Kun olet löytänyt isotoopin atomimassan, jäljellä olevat vaiheet neutronien lukumäärän löytämiseksi ovat samat kuin normaalin atomin.
Vähennä atomiluku atomimassasta. Koska suurin osa atomimassasta on protonien ja neutronien massa, vähentämällä protonien lukumäärä atomimassasta (ts. Atomiluku), saat Kreivi saat neutronien määrän atomissa. Desimaalipisteen jälkeinen luku edustaa hyvin pientä elektronimassaa atomissa. Tässä esimerkissä meillä on: 14 (massatomi) - 6 (protonien lukumäärä) = 8 (neutronien lukumäärä).
Muista resepti. Neutronien lukumäärän löytämiseksi käytämme seuraavaa kaavaa:
- N = M - n
- N = neutronien lukumäärä
- M = atomimassa
- n = atomiluku
- N = M - n
Neuvoja
- Elementin massa on suurelta osin protonien ja neutronien massa, kun taas elektronien ja muiden alkuaineiden massa on merkityksetön (lähellä nollaa). Koska protonin massa on suunnilleen yhtä suuri kuin neutronin massa ja atomiluku edustaa protonien lukumäärää, meidän on vain vähennettävä protonien määrä kokonaismassasta.
- Jos et muista jaksollisen taulukon numeroiden merkitystä, muista, että jaksollinen taulukko on yleensä rakennettu atomilukuihin (eli protonien lukumäärään) alkaen 1: stä (vety) ja lisäämällä yhtä yksikköä vasemmalta oikealle, päättyen 118: een (ununoktium). Koska protonien lukumäärä on kunkin atomin tunnistava piirre, se on yksinkertaisin ominaisuus järjestää elementit. (Esimerkiksi atomi, jossa on kaksi protonia, on aina heliumia, aivan kuten atomi, jossa on 79 protonia, on aina kultaa.)
Lähteet ja lainaukset
- Interaktiivinen jaksollinen taulukko