Kirjoittaja:
Eric Farmer
Luomispäivä:
10 Maaliskuu 2021
Päivityspäivä:
1 Heinäkuu 2024
Sisältö
- Askeleet
- Menetelmä 1/2: Atomien (ei isotooppien) neutronien lukumäärän määrittäminen
- Menetelmä 2/2: Neutronien lukumäärän määrittäminen isotooppeissa
- Vinkkejä
Saman alkuaineen atomeissa protonien lukumäärä on vakio, kun taas neutronien lukumäärä voi vaihdella.Kun tiedät kuinka monta neutronia tietty atomi sisältää, voit määrittää, onko se tavallinen atomi vai isotooppi, jossa on vähemmän tai enemmän neutroneja. Neutronien lukumäärän määrittäminen atomissa on melko yksinkertaista. Ainoa mitä sinun tarvitsee tehdä neutronien lukumäärän laskemiseksi atomissa tai isotoopissa, on seurata ohjeitamme ja pitää jaksollinen taulukko käsillä.
Askeleet
Menetelmä 1/2: Atomien (ei isotooppien) neutronien lukumäärän määrittäminen
 1 Etsi elementti jaksollisesta taulukosta. Esimerkkinä tarkastellaan osmiumia (Os), joka on kuudennella jaksolla (kuudes rivi ylhäältä).
1 Etsi elementti jaksollisesta taulukosta. Esimerkkinä tarkastellaan osmiumia (Os), joka on kuudennella jaksolla (kuudes rivi ylhäältä).  2 Etsi alkuaineen atominumero. Tämä on pääsääntöisesti havaittavin luku elementin solussa ja sijaitsee yleensä sen symbolin yläpuolella (esimerkissä käyttämämme jaksollisen taulukon versiossa ei ole muita numeroita). Atomiluku on protonien lukumäärä kyseisen elementin yhdessä atomissa. Osmiumin osalta tämä luku on 76, eli yhdessä osmiumatomissa on 76 protonia.
2 Etsi alkuaineen atominumero. Tämä on pääsääntöisesti havaittavin luku elementin solussa ja sijaitsee yleensä sen symbolin yläpuolella (esimerkissä käyttämämme jaksollisen taulukon versiossa ei ole muita numeroita). Atomiluku on protonien lukumäärä kyseisen elementin yhdessä atomissa. Osmiumin osalta tämä luku on 76, eli yhdessä osmiumatomissa on 76 protonia. - Protonien määrä on muuttumaton, ja tämä tekee elementistä elementin.
 3 Etsi alkuaineen atomimassa. Tämä numero löytyy yleensä elementtisymbolin alapuolelta. Huomaa, että esimerkissämme olevan jaksollisen taulukon versiossa atomimassaa ei ilmoiteta (näin ei aina ole; monissa jaksollisen taulukon versioissa atomimassa on ilmoitettu). Osmiumin atomimassa on 190,23.
3 Etsi alkuaineen atomimassa. Tämä numero löytyy yleensä elementtisymbolin alapuolelta. Huomaa, että esimerkissämme olevan jaksollisen taulukon versiossa atomimassaa ei ilmoiteta (näin ei aina ole; monissa jaksollisen taulukon versioissa atomimassa on ilmoitettu). Osmiumin atomimassa on 190,23.  4 Pyöristä atomimassa lähimpään kokonaislukuun. Esimerkissämme 190,23 pyöristetään arvoon 190.
4 Pyöristä atomimassa lähimpään kokonaislukuun. Esimerkissämme 190,23 pyöristetään arvoon 190. - Atomimassa on tietyn elementin isotooppien keskimääräinen lukumäärä, yleensä sitä ei ilmaista kokonaislukuna.
 5 Vähennä atomiluku atomimassasta. Koska protonit ja neutronit muodostavat atomimassan absoluuttisen osan, vähennetään atomien massasta protonien lukumäärä (eli atomiluku, joka on yhtä suuri kuin protonien lukumäärä), jolloin saadaan neutronien määrä atomissa. Desimaalipilkun jälkeiset luvut viittaavat atomin elektronien hyvin pieneen massaan. Esimerkissämme: 190 (atomipaino) - 76 (protonien lukumäärä) = 114 (neutronien lukumäärä).
5 Vähennä atomiluku atomimassasta. Koska protonit ja neutronit muodostavat atomimassan absoluuttisen osan, vähennetään atomien massasta protonien lukumäärä (eli atomiluku, joka on yhtä suuri kuin protonien lukumäärä), jolloin saadaan neutronien määrä atomissa. Desimaalipilkun jälkeiset luvut viittaavat atomin elektronien hyvin pieneen massaan. Esimerkissämme: 190 (atomipaino) - 76 (protonien lukumäärä) = 114 (neutronien lukumäärä).  6 Muista kaava. Jos haluat löytää neutronien määrän tulevaisuudessa, käytä tätä kaavaa:
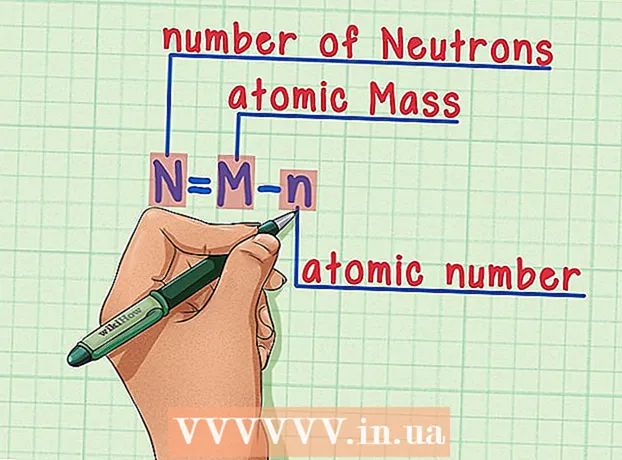
6 Muista kaava. Jos haluat löytää neutronien määrän tulevaisuudessa, käytä tätä kaavaa: - N = M - n
- N = neutronien lukumäärä
- M = atomimassa
- n = atomiluku
- N = M - n
Menetelmä 2/2: Neutronien lukumäärän määrittäminen isotooppeissa
 1 Etsi elementti jaksollisesta taulukosta. Esimerkkinä tarkastellaan hiilen 14C isotooppia. Koska ei-isotooppinen hiili 14C on vain hiili C, etsi hiiltä jaksollisesta taulukosta (toinen jakso tai toinen rivi ylhäältä).
1 Etsi elementti jaksollisesta taulukosta. Esimerkkinä tarkastellaan hiilen 14C isotooppia. Koska ei-isotooppinen hiili 14C on vain hiili C, etsi hiiltä jaksollisesta taulukosta (toinen jakso tai toinen rivi ylhäältä).  2 Etsi alkuaineen atominumero. Tämä on pääsääntöisesti havaittavin luku elementin solussa ja sijaitsee yleensä sen symbolin yläpuolella (esimerkissä käyttämämme jaksollisen taulukon versiossa ei ole muita numeroita). Atomiluku on protonien lukumäärä kyseisen elementin yhdessä atomissa. Hiili on numero 6, mikä tarkoittaa, että yhdellä hiilellä on kuusi protonia.
2 Etsi alkuaineen atominumero. Tämä on pääsääntöisesti havaittavin luku elementin solussa ja sijaitsee yleensä sen symbolin yläpuolella (esimerkissä käyttämämme jaksollisen taulukon versiossa ei ole muita numeroita). Atomiluku on protonien lukumäärä kyseisen elementin yhdessä atomissa. Hiili on numero 6, mikä tarkoittaa, että yhdellä hiilellä on kuusi protonia.  3 Etsi atomimassa. Isotooppien tapauksessa tämä on erittäin helppo tehdä, koska ne on nimetty niiden atomimassan mukaan. Meidän tapauksessamme hiilen 14C atomimassa on 14. Nyt tiedämme isotoopin atomimassan; seuraava laskentaprosessi on sama kuin neutronien lukumäärän määrittäminen atomeissa (ei isotooppeja).
3 Etsi atomimassa. Isotooppien tapauksessa tämä on erittäin helppo tehdä, koska ne on nimetty niiden atomimassan mukaan. Meidän tapauksessamme hiilen 14C atomimassa on 14. Nyt tiedämme isotoopin atomimassan; seuraava laskentaprosessi on sama kuin neutronien lukumäärän määrittäminen atomeissa (ei isotooppeja).  4 Vähennä atomiluku atomimassasta. Koska protonit ja neutronit muodostavat atomimassan absoluuttisen osan, vähennetään atomien massasta protonien lukumäärä (eli atomiluku, joka on yhtä suuri kuin protonien lukumäärä), jolloin saadaan neutronien määrä atomissa. Esimerkissämme: 14 (atomimassa) - 6 (protonien lukumäärä) = 8 (neutronien lukumäärä).
4 Vähennä atomiluku atomimassasta. Koska protonit ja neutronit muodostavat atomimassan absoluuttisen osan, vähennetään atomien massasta protonien lukumäärä (eli atomiluku, joka on yhtä suuri kuin protonien lukumäärä), jolloin saadaan neutronien määrä atomissa. Esimerkissämme: 14 (atomimassa) - 6 (protonien lukumäärä) = 8 (neutronien lukumäärä).  5 Muista kaava. Jos haluat löytää neutronien määrän tulevaisuudessa, käytä tätä kaavaa:
5 Muista kaava. Jos haluat löytää neutronien määrän tulevaisuudessa, käytä tätä kaavaa: - N = M - n
- N = neutronien lukumäärä
- M = atomimassa
- n = atomiluku
- N = M - n
Vinkkejä
- Protonit ja neutronit muodostavat lähes elementtien absoluuttisen massan, kun taas elektronit ja muut hiukkaset muodostavat erittäin merkityksettömän massan (tämä massa pyrkii nollaan).Koska yhdellä protonilla on suunnilleen sama massa kuin yhdellä neutronilla ja atomiluku on protonien lukumäärä, voit yksinkertaisesti vähentää protonien määrän kokonaismassasta.
- Osmium - metalli, joka on kiinteässä tilassa huoneenlämmössä, sai nimensä kreikkalaisesta sanasta "osme" - haju.
- Jos et ole varma, mitä jaksollisen taulukon numero tarkoittaa, muista: taulukko on yleensä rakennettu atomiluvun (eli protonien) ympärille, joka alkaa 1: stä (vety) ja kasvaa yhden yksikön vasemmalta oikealle , päättyy numeroon 118 (Oganesson). Tämä johtuu siitä, että atomien protonien lukumäärä määrää itse elementin, ja tällainen luku on helpoin tapa järjestää elementit (esimerkiksi 2 protonin atomi on aina helium, aivan kuten 79 protonin atomit ovat aina kultaa ).



