Kirjoittaja:
Randy Alexander
Luomispäivä:
25 Huhtikuu 2021
Päivityspäivä:
26 Kesäkuu 2024
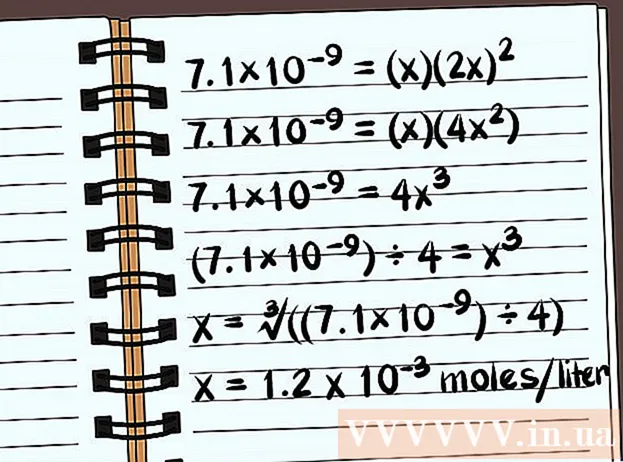
Sisältö
Kemiassa liukoisuutta käytetään kuvaamaan kiinteän yhdisteen ominaisuuksia, kun se liuotetaan kokonaan nesteeseen jättämättä liukenematonta jäännöstä. Vain ioniset yhdisteet (varatut) ovat liukoisia. Itse asiassa sinun tarvitsee vain muistaa muutama periaate tai etsiä kirjallisuutta tietääksesi, pysyykö ioninen yhdiste kiinteänä, kun se lisätään veteen vai liukenee suuri määrä. Itse asiassa tietty määrä molekyylejä liukenee, vaikka et näe muutosta, joten kokeen ollessa tarkka on tiedettävä, kuinka tämä liuenneen aineen määrä lasketaan.
Askeleet
Tapa 1/2: Käytä nopeita sääntöjä
Tutustu ioniyhdisteisiin. Jokaisella atomilla on yleensä tietty määrä elektroneja, mutta joskus se saa tai antaa pois elektronin. Tämä prosessi tekee siitä yhden ioneja ladattu. Kun negatiivisen varauksen omaava ioni (yhden elektronin ylimäärä) kohtaa ionin, jolla on positiivinen varaus (puuttuu elektroni), ne sitoutuvat yhteen kuten kahden magneetin katodi ja anodi. Tulos muodostaa ionisen yhdisteen.
- Ioneilla on negatiivinen varaus anionitja ioneilla on positiivinen varaus kationia.
- Normaalisti elektronien määrä atomissa on yhtä suuri kuin protonien lukumäärä, joten sillä ei ole varausta.

Ymmärrä liukoisuus. Vesimolekyyli (H2O): lla on epäsäännöllinen rakenne, joten se muistuttaa magneettia: toisessa päässä on positiivinen varaus ja toisessa negatiivinen varaus. Kun laitat ionisen yhdisteen veteen, nämä veden "magneetit" kerääntyvät sen ympärille yrittäen vetää positiiviset ja negatiiviset ionit erilleen.- Jotkut ioniset yhdisteet eivät imeydy kovin tiukasti, niitä pidetään liukeneva Koska se erottuu ja liukenee, kun se lisätään veteen. Muilla yhdisteillä on vahvemmat sidokset liukenematon koska ionit vetävät toisiinsa tiukasti vesimolekyylin vetovoimasta riippumatta.
- Joillakin yhdisteillä on sitova voima, joka vastaa vesimolekyylin vetovoimaa. Niitä pidetään liukenee vähän koska useimmat yhdisteet erotetaan, mutta loput vetävät silti toisiaan.

Ymmärrä hajoamisen periaate. Koska atomien välinen vuorovaikutus on niin monimutkaista, et voi luottaa täysin intuitioon erottaaksesi yhdisteet, jotka voivat tai eivät. Etsi alla olevan luettelon yhdisteen ensimmäinen ioni sen yhteisten ominaisuuksien suhteen ja tarkista sitten poikkeukset varmistaaksesi, että toinen ioni ei ole vuorovaikutuksessa sen kanssa epänormaalisti.- Esimerkiksi strontiumkloridin (SrCl2), etsi Sr tai Cl alla olevista lihavoiduista vaiheista. Cl on "tavallisesti liukoinen", joten tarkista mahdolliset poikkeukset sen alapuolelta. Sr ei ole poikkeusluettelossa, joten SrCl2 täytyy olla liukoinen.
- Kunkin säännön yleisimmät poikkeukset on kirjoitettu säännön alle. On muitakin poikkeuksia, mutta niitä ei todennäköisesti tapahdu normaalin kemian tai laboratoriotuntien aikana.

Yhdisteet ovat liukoisia, kun ne sisältävät alkalimetalleja, kuten Li, Na, K, Rb ja Cs. Nämä metallit tunnetaan myös ryhmän IA alkuaineina: litium, natrium, kalium, rubidium ja cesium. Lähes kaikki yhdet näistä ioneista sisältävät aineet ovat liukoisia.- Poikkeus: Li3PO4 liukenematon.
EI yhdisteitä3, C2H3O2, EI2, ClO3 ja ClO4 ovat kaikki liukoisia. Edellä mainittuja ioneja vastaavat nimet ovat nitraatti, asetaatti, nitriitti, kloraatti ja perkloraatti. Huomaa, että asetaatti lyhennetään usein OAc: ksi.
- Poikkeus: Ag (OAc) (hopeasetaatti) ja Hg (OAc)2 (elohopeasetaatti) liukenematon.
- AgNO2 ja KClO4 vain "hieman sulanut".
Cl: n, Br: n ja I: n yhdisteet ovat yleensä liukoisia. Kloridi-, bromidi- ja jodidi-ionit muodostavat melkein aina liukoisia yhdisteitä, joita kutsutaan halogeenisuoloiksi.
- Poikkeus: Jos jokin yllä olevista ioneista yhdistyy hopeaionien Ag, elohopea Hg2tai Pb-lyijy muodostaa liukenemattomia yhdisteitä. Sama pätee harvinaisempiin yhdisteisiin, jotka muodostuvat yhdistettynä kuparin Cu ja thali Tl kanssa.
SO: ta sisältävät yhdisteet4 yleensä liukoinen. Sulfaatti-ionit muodostavat usein liukoisia yhdisteitä, mutta on monia poikkeuksia.
- Poikkeus: Sulfaatti-ionit muodostavat liukenemattoman yhdisteen seuraavien ionien kanssa: strontium Sr, barium Ba, lyijy Pb, hopea Ag, kalsium Ca, radium Ra ja hopeamonatomi Ag2. Huomaa, että hopeasulfaatti ja kalsiumsulfaatti ovat vain kohtuullisen liukoisia, joten jotkut pitävät niitä liukoisina.
OH: ta tai S: ää sisältävät aineet ovat liukenemattomia. Näiden ionien vastaavat nimet ovat hydroksideja ja sulfideja.
- Poikkeus: Muistatko alkalimetalleja (ryhmät I-A) ja kuinka he haluavat muodostaa liukoisia yhdisteitä? Li, Na, K, Rb ja Cs muodostavat kaikki yhdisteet, jotka ovat liukoisia hydroksidi- tai sulfidi-ionien kanssa. Lisäksi hydroksidit muodostavat suoloja, jotka ovat liukoisia maa-alkalimetalli-ionien (ryhmä II-A) kanssa: kalsium Ca, strontium Sr ja barium Ba. Huomaa: Hydroksideista ja maa-alkalimetalleista valmistetuissa yhdisteissä on itse asiassa merkittävä määrä molekyylejä, jotka pysyvät sidoksissa toisiinsa, joten niitä pidetään joskus "hieman liukoisina".
CO: ta sisältävät yhdisteet3 tai PO4 liukenematon. Tarkista viimeinen kerta karbonaatti- ja fosfaatti-ionien varalta ja näet, onko yhdiste liukoinen.
- Poikkeus: Nämä ionit muodostavat yhdisteitä, jotka ovat liukoisia alkalimetallien, kuten Li, Na, K, Rb ja Cs, sekä ammoniumioni NH: n kanssa.4.
Menetelmä 2/2: Lasketaan liukoisuus vakiosta Ksp
Etsi liukoisuustuotevakio Ksp. Tämä vakio on erilainen kullekin yhdisteelle, joten sinun tulisi etsiä se kaaviosta oppikirjasta tai verkosta. Koska nämä arvot määritetään kokeellisesti ja ne voivat vaihdella merkittävästi kaavioiden välillä, on parasta käyttää oppikirjakaaviota, jos se on käytettävissä. Ellei toisin mainita, useimmissa koealueissa oletetaan testilämpötila 25 ºC.
- Oletetaan esimerkiksi, että liuotat lyijyjodidia kaavalla PbI2, kirjoita sen liukoisuustuotevakio. Jos viitataan kaavioon osoitteessa bilbo.chm.uri.edu, käytetään vakiota 7,1 × 10.
Kirjoita kemiallinen yhtälö. Ensin määritetään tämän yhdisteen ioninen erotuskuvio liuenneena. Kirjoita sitten yhtälö K: n kanssasp toisella puolella ja komponentti-ionit toisella puolella.
- Esimerkiksi PbI-molekyyli2 hajoaa ioneiksi Pb, I ja I. (Sinun tarvitsee vain tietää tai tarkistaa ionin varaus, koska kaikki yhdisteet ovat aina sähköisesti neutraaleja).
- Kirjoita yhtälö 7,1 × 10 =
- Tämä yhtälö on liukoisuusvakio, voit selvittää 2 ionia liukoisuuskaaviosta. Koska lioneja on 2, l- on oltava neliöllisiä.
Muunna yhtälöt muuttujien käyttämiseksi. Kirjoita yhtälö uudestaan normaaleilla algebrallisilla menetelmillä käyttämällä molekyylien ja ionien lukumäärästä tiedämääsi tietoa. Aseta x yhtä suureksi kuin liuenneen yhdisteen massa, ja kirjoita yhtälö, jossa x edustaa kunkin ionin lukumäärää.
- Tässä esimerkissä meidän on kirjoitettava yhtälö 7,1 × 10 =
- Koska yhdisteessä on vain yksi lyijyioni (Pb), liuenneiden molekyylien määrä on yhtä suuri kuin vapaiden lyijyionien lukumäärä. Siksi voimme asettaa sen arvoksi x.
- Koska kullekin lyijyionille on kaksi jodi-ionia (I), asetamme jodiatomien lukumääräksi 2x.
- Nyt yhtälöstä tulee 7,1 × 10 = (x) (2x)
Ota huomioon mahdolliset tavalliset ionit. Ohita tämä vaihe, jos liuotat yhdistettä tislattuun veteen. Jos yhdiste liuotetaan liuokseen, jossa on jo yksi tai useampia komponentti-ioneja ("tavalliset ionit"), yhdisteen liukoisuus vähenee merkittävästi. Yleisten ionien vaikutus on ilmeisin käytännöllisesti katsoen liukenemattomiin yhdisteisiin, ja tässä tapauksessa voit olettaa, että suurin osa tasapainossa olevista ioneista on aiemmin liuoksessa olevia ioneja. Kirjoita yhtälö uudelleen laskeaksesi liuoksessa jo olevien ionien moolipitoisuuden (mol / litra tai M), korvaamalla tämä arvo muuttujalla x, jota käytät tälle ionille.
- Esimerkiksi jos lyijyjodidiyhdiste liuotetaan 0,2 M lyijykloridiliuokseen (PbCl)2), kirjoitamme yhtälön uudelleen muodossa 7,1 × 10 = (0,2 M + x) (2x). Koska 0,2 M on suurempi pitoisuus kuin x, voimme kirjoittaa sen uudelleen arvoon 7,1 × 10 = (0,2 M) (2x).
Ratkaise yhtälö. Ratkaise x, niin näet yhdisteen liukoisuuden. Liukoisuusvakion määritelmässä sinun on kirjoitettava vastauksesi liuenneen yhdisteen moolimääränä vesilitraa kohti. Saatat joutua käyttämään tietokonetta lopullisen vastauksen löytämiseen.
- Seuraava esimerkki on liukoisuus tislattuun veteen ilman yleisiä ioneja.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 moolia litrassa liukenee. Tämä on hyvin pieni massa, joten tämä yhdiste on melkein liukenematon.
Mitä tarvitset
- Taulukko yhdisteen liukoisuustuotevakioista (Ksp)
Neuvoja
- Jos sinulla on kokeellisia tietoja liuenneiden yhdisteiden määrästä, voit käyttää samaa yhtälöä ratkaisemaan liukoisuusvakion K.sp.
Varoitus
- Näiden termien määritelmistä ei ole yksimielisyyttä, mutta kemistit ovat yhtä mieltä useimmista yhdisteistä. Lukuisia erityisiä yhdisteitä, joissa sekä liukoiset että liukenemattomat molekyylit muodostavat merkittäviä ainesosia, joista jokaisella on erilainen kuvaus näistä yhdisteistä.
- Jotkut vanhat oppikirjat näkevät NH: n4OH on liukoinen yhdiste. Tämä ei ole totta; Pieniä määriä NH-ioneja havaittiin4 ja OH, mutta nämä kaksi ionia eivät voi yhdistää yhdisteiksi.