Kirjoittaja:
Frank Hunt
Luomispäivä:
16 Maaliskuu 2021
Päivityspäivä:
1 Heinäkuu 2024
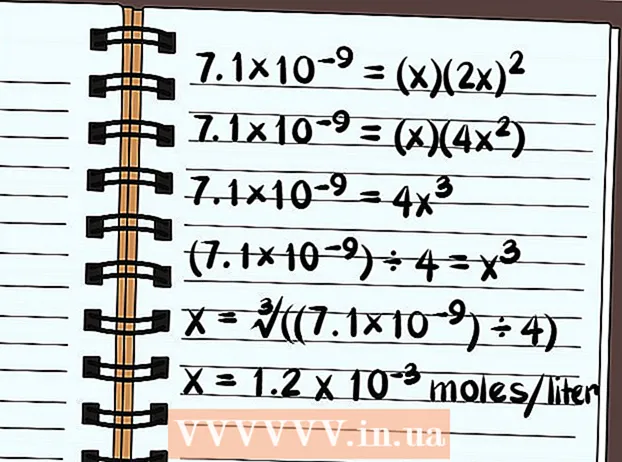
Sisältö
- Astua
- Tapa 1/2: Pikasääntöjen käyttö
- Menetelmä 2/2: K: n liukoisuuden laskeminensp
- Tarpeet
- Vinkkejä
- Varoitukset
Kemiassa liukoisuutta käytetään kuvaamaan kiinteän aineen, joka sekoittuu nesteeseen ja liukenee siihen kokonaan, jättämättä liukenemattomia hiukkasia. Vain (varatut) ioniset yhdisteet ovat liukoisia. Käytännön syistä muutamien sääntöjen muistaminen tai sääntöjen luettelon tarkastelu riittää kertomaan sinulle, pysyykö suurin osa ioniyhdisteistä kiinteitä sekoitettuna veteen tai liukenee merkittävä määrä. Todellisuudessa jotkut molekyylit liukenevat, vaikka et näe muutoksia, joten tarkkoja kokeita varten sinun on tiedettävä, kuinka tämä määrä lasketaan.
Astua
Tapa 1/2: Pikasääntöjen käyttö
 Tietää enemmän ionisista yhdisteistä. Jokaisessa atomissa on normaalisti useita elektroneja, mutta joskus ne hankkivat tai menettävät yhden ylimääräisen elektronin. Tulos on yksi ioni sähkövarauksella. Kun negatiivisen varauksen omaava ioni (ylimääräinen elektroni) kohtaa positiivisen varauksen sisältävän ionin (elektroni puuttuu), ne sitoutuvat yhteen, aivan kuten kahden magneetin negatiiviset ja positiiviset päät. Tuloksena on ionisidos.
Tietää enemmän ionisista yhdisteistä. Jokaisessa atomissa on normaalisti useita elektroneja, mutta joskus ne hankkivat tai menettävät yhden ylimääräisen elektronin. Tulos on yksi ioni sähkövarauksella. Kun negatiivisen varauksen omaava ioni (ylimääräinen elektroni) kohtaa positiivisen varauksen sisältävän ionin (elektroni puuttuu), ne sitoutuvat yhteen, aivan kuten kahden magneetin negatiiviset ja positiiviset päät. Tuloksena on ionisidos. - Negatiivisen varauksen ioneja kutsutaan anionitja positiivisen varauksen ionit kationit.
- Normaalisti elektronien määrä atomissa on yhtä suuri kuin protonien lukumäärä, joissa sähkövarat ovat tasapainossa.
 Tunne liukoisuus. Vesimolekyylit (H.2O) niillä on epätavallinen rakenne, jolla ne käyttäytyvät kuin magneetti: toisessa päässä on positiivinen varaus, kun taas toisessa päässä on negatiivinen varaus. Kun sekoitat ionisidoksen veteen, nämä "vesimagneetit" kerääntyvät sen ympärille yrittäen vetää positiiviset ja negatiiviset ionit erilleen. Jotkut ionisidokset eivät ole kovin tiiviisti toisiinsa; nämä ovat liukenevakoska vesi repii ja liuottaa sidoksen. Muilla komposiiteilla on vahvemmat sidokset ja ovat Ei ratkaistavissakoska ne voivat tarttua yhteen vesimolekyyleistä huolimatta.
Tunne liukoisuus. Vesimolekyylit (H.2O) niillä on epätavallinen rakenne, jolla ne käyttäytyvät kuin magneetti: toisessa päässä on positiivinen varaus, kun taas toisessa päässä on negatiivinen varaus. Kun sekoitat ionisidoksen veteen, nämä "vesimagneetit" kerääntyvät sen ympärille yrittäen vetää positiiviset ja negatiiviset ionit erilleen. Jotkut ionisidokset eivät ole kovin tiiviisti toisiinsa; nämä ovat liukenevakoska vesi repii ja liuottaa sidoksen. Muilla komposiiteilla on vahvemmat sidokset ja ovat Ei ratkaistavissakoska ne voivat tarttua yhteen vesimolekyyleistä huolimatta. - Joissakin liitännöissä on sisäisiä sidoksia, jotka ovat lujuudeltaan verrattavissa veden vetoon. Nämä aineet ovat kohtalaisesti liukoinen, koska merkittävä osa (mutta ei kaikki) joukkovelkakirjoista vedetään irti.
 Tutki liukoisuuden sääntöjä. Koska atomien väliset vuorovaikutukset ovat melko monimutkaisia, ei ole aina intuitiivista, mitkä yhdisteet ovat liukoisia ja liukenemattomia. Löydä yhdisteen ensimmäinen ioni alla olevasta luettelosta saadaksesi selville, miten se yleensä käyttäytyy, ja tarkista sitten poikkeukset varmistaaksesi, että toinen ioni ei ole vuorovaikutuksessa epänormaalisti.
Tutki liukoisuuden sääntöjä. Koska atomien väliset vuorovaikutukset ovat melko monimutkaisia, ei ole aina intuitiivista, mitkä yhdisteet ovat liukoisia ja liukenemattomia. Löydä yhdisteen ensimmäinen ioni alla olevasta luettelosta saadaksesi selville, miten se yleensä käyttäytyy, ja tarkista sitten poikkeukset varmistaaksesi, että toinen ioni ei ole vuorovaikutuksessa epänormaalisti. - Esimerkiksi strontiumkloridin (SrCl2), etsi Sr tai Cl alla olevilla lihavoiduilla vaiheilla. Cl on "enimmäkseen ratkaistavissa", joten tarkista alla olevat poikkeukset. Sr: ää ei ole merkitty poikkeuksena, joten SrCl2 olla liukoinen.
- Alla on lueteltu yleisimmät poikkeukset kustakin säännöstä. On muitakin poikkeuksia, mutta et todennäköisesti löydä niitä yhteisestä kemian luokasta tai laboratoriosta.
 Yhdisteet ovat liukoisia, kun ne sisältävät alkalimetalleja, mukaan lukien Li, Na, K, Rb ja Cs. Näitä kutsutaan myös ryhmän IA elementeiksi: litium, natrium, kalium, rubidium ja cesium. Lähes mikä tahansa yhdiste näiden ionien kanssa on liukoinen.
Yhdisteet ovat liukoisia, kun ne sisältävät alkalimetalleja, mukaan lukien Li, Na, K, Rb ja Cs. Näitä kutsutaan myös ryhmän IA elementeiksi: litium, natrium, kalium, rubidium ja cesium. Lähes mikä tahansa yhdiste näiden ionien kanssa on liukoinen. - Poikkeus: Li3PO4 ei ole liukoinen.
 Yhdisteet NO: n kanssa3, C2H.3O2, EI2, ClO3 ja ClO4 ovat liukoisia. Nämä ovat vastaavasti nitraatti-, asetaatti-, nitriitti-, kloraatti- ja perkloraatti-ionit. Huomaa, että asetaatti lyhennetään usein OAc: llä.
Yhdisteet NO: n kanssa3, C2H.3O2, EI2, ClO3 ja ClO4 ovat liukoisia. Nämä ovat vastaavasti nitraatti-, asetaatti-, nitriitti-, kloraatti- ja perkloraatti-ionit. Huomaa, että asetaatti lyhennetään usein OAc: llä. - Poikkeukset: Ag (OAc) (hopeasetaatti) ja Hg (OAc)2 (elohopeasetaatti) eivät ole liukoisia.
- AgNO2 ja KClO4 ovat vain "osittain liukoisia".
 yhdisteet Cl: n, Br: n ja I: n kanssa ovat yleensä liukoisia. Kloridi-, bromidi- ja jodidi-ionit muodostavat melkein aina liukoisia yhdisteitä, jotka tunnetaan myös nimellä halogeenisuolat.
yhdisteet Cl: n, Br: n ja I: n kanssa ovat yleensä liukoisia. Kloridi-, bromidi- ja jodidi-ionit muodostavat melkein aina liukoisia yhdisteitä, jotka tunnetaan myös nimellä halogeenisuolat. - Poikkeus: Jos jompikumpi näistä sitoutuu hopeaioneilla (Ag), elohopea (Hg2) tai lyijyä (Pb), tulos ei ole liukoinen. Sama koskee harvinaisempia yhdisteitä, joissa on kupari (Cu) ja tallium (Tl).
 Yhteydet SO: han4 ovat yleensä liukoisia. Sulfaatti-ioni muodostaa yleensä liukoisia yhdisteitä, mutta on olemassa useita poikkeuksia.
Yhteydet SO: han4 ovat yleensä liukoisia. Sulfaatti-ioni muodostaa yleensä liukoisia yhdisteitä, mutta on olemassa useita poikkeuksia. - Poikkeukset: Sulfaatti-ioni muodostaa liukenemattomia yhdisteitä seuraavien ionien kanssa: strontium Sr, barium Ba, lyijy Pb, hopea Ag, kalsium Ca, radium Ra ja piimaa hopea Ag2. Huomaa, että hopeasulfaatti ja kalsiumsulfaatti liukenevat juuri niin paljon, että niitä kutsutaan joskus niukkaliukoisiksi.
 Yhdisteet, joissa on OH tai S, eivät ole liukoisia. Nämä ovat hydroksidi- ja sulfidi-ionit, vastaavasti.
Yhdisteet, joissa on OH tai S, eivät ole liukoisia. Nämä ovat hydroksidi- ja sulfidi-ionit, vastaavasti. - Poikkeukset: Muistatko alkalimetallit (ryhmä I-A) ja kuinka paljon he haluavat muodostaa liukenemattomia yhdisteitä? Li, Na, K, Rb ja Cs muodostavat kaikki liukoisia yhdisteitä hydroksidi- tai sulfidi-ionien kanssa. Lisäksi hydroksidi muodostaa liukoisia suoloja maa-alkalimetallien (ryhmä II-A) ionien kanssa: kalsium Ca, strontium Sr ja barium Ba. Huomaa, että maa-alkalimetalliyhdisteen sisältämässä hydroksidissa on vain tarpeeksi molekyylejä tarttumaan yhteen, jotta sitä voidaan joskus pitää "vähän liukoisena".
 Yhdisteet CO: n kanssa3 tai PO4 eivät ole liukoisia. Tarkista viimeinen kerta karbonaatti- ja fosfaatti-ionien varalta, ja sinun pitäisi tietää mitä odottaa yhdisteeltä.
Yhdisteet CO: n kanssa3 tai PO4 eivät ole liukoisia. Tarkista viimeinen kerta karbonaatti- ja fosfaatti-ionien varalta, ja sinun pitäisi tietää mitä odottaa yhdisteeltä. - Poikkeukset: Nämä ionit muodostavat liukoisia yhdisteitä tavallisten aineiden, alkalimetallien Li, Na, K, Rb ja Cs sekä ammonium NH: n kanssa.4.
Menetelmä 2/2: K: n liukoisuuden laskeminensp
 Etsi vakion K liukoisuustuote.sp. Tämä vakio on erilainen kullekin yhteydelle, joten sinun on etsittävä sitä oppikirjan taulusta tai verkossa. Koska nämä arvot määritetään kokeellisesti, ne voivat vaihdella suuresti taulukosta toiseen, joten on parasta käyttää oppikirjan taulukkoa, jos sellaista on. Ellei toisin mainita, useimmissa taulukoissa oletetaan, että ympäristön lämpötila on 25 ° C.
Etsi vakion K liukoisuustuote.sp. Tämä vakio on erilainen kullekin yhteydelle, joten sinun on etsittävä sitä oppikirjan taulusta tai verkossa. Koska nämä arvot määritetään kokeellisesti, ne voivat vaihdella suuresti taulukosta toiseen, joten on parasta käyttää oppikirjan taulukkoa, jos sellaista on. Ellei toisin mainita, useimmissa taulukoissa oletetaan, että ympäristön lämpötila on 25 ° C. - Esimerkiksi, jos haluat liuottaa lyijyjodidia (PbI2), kirjoita liukoisuustuotteen tasapainovakio. Jos käytät taulukkoa osoitteessa bilbo.chm.uri.edu, käytä vakiota 7,1 × 10.
 Kirjoita ensin kemiallinen yhtälö. Ensin määritetään, miten yhdiste hajoaa ioneiksi, kun se liukenee. Kirjoita nyt yhtälö K: n kanssa.sp toisaalta ja toisaalta yksittäiset ionit.
Kirjoita ensin kemiallinen yhtälö. Ensin määritetään, miten yhdiste hajoaa ioneiksi, kun se liukenee. Kirjoita nyt yhtälö K: n kanssa.sp toisaalta ja toisaalta yksittäiset ionit. - Esimerkiksi PbI-molekyyli2 jakautuu ioneiksi Pb, I ja toiseen I (sinun tarvitsee vain tietää tai etsiä yhden ionin varaus, koska tiedät, että kokonaisyhdisteellä on aina neutraali varaus).
- Kirjoita yhtälö 7,1 × 10 = [Pb] [I]
 Säädä yhtälöä muuttujien käyttämiseksi. Kirjoita yhtälö uudelleen yhtenä algebraongelmana käyttämällä molekyylien tai ionien lukumäärääsi. Aseta x yhtä suureksi kuin aineen määrä, joka liukenee, ja kirjoita muuttujat uudelleen kunkin ionin numeroiksi x: nä.
Säädä yhtälöä muuttujien käyttämiseksi. Kirjoita yhtälö uudelleen yhtenä algebraongelmana käyttämällä molekyylien tai ionien lukumäärääsi. Aseta x yhtä suureksi kuin aineen määrä, joka liukenee, ja kirjoita muuttujat uudelleen kunkin ionin numeroiksi x: nä. - Esimerkissämme kirjoitamme uudelleen 7,1 × 10 = [Pb] [I]
- Koska yhdisteessä on vain yksi lyijyioni (Pb), liuenneiden yhdistemolekyylien lukumäärä on yhtä suuri kuin vapaiden lyijyionien lukumäärä. Joten voimme korvata [Pb] x: llä.
- Koska kutakin lyijyionia varten on kaksi jodi-ionia (I), voimme yhtyä jodiatomien lukumäärään 2x.
- Yhtälön lukema on nyt 7,1 × 10 = (x) (2x)
 Harkitse mahdollisia ioneja. Ohita tämä vaihe, jos liuotat yhdistettä puhtaaseen veteen. Kuitenkin, jos yhdiste liuotetaan liuokseen, joka sisältää jo yhden tai useamman ainesosan ("tavallinen ioni"), liukoisuus vähenee merkittävästi. Yleisten ionien vaikutus on huomattavin yhdisteissä, jotka ovat enimmäkseen liukenemattomia, ja näissä tapauksissa voidaan olettaa, että valtaosa tasapainossa olevista ioneista tulee jo liuoksessa olevasta ionista. Kirjoita yhtälö uudelleen liuoksessa jo olevien ionien tunnetulla moolipitoisuudella (moolia litrassa tai M) korvaamalla tälle ionille käytetyn x: n arvo.
Harkitse mahdollisia ioneja. Ohita tämä vaihe, jos liuotat yhdistettä puhtaaseen veteen. Kuitenkin, jos yhdiste liuotetaan liuokseen, joka sisältää jo yhden tai useamman ainesosan ("tavallinen ioni"), liukoisuus vähenee merkittävästi. Yleisten ionien vaikutus on huomattavin yhdisteissä, jotka ovat enimmäkseen liukenemattomia, ja näissä tapauksissa voidaan olettaa, että valtaosa tasapainossa olevista ioneista tulee jo liuoksessa olevasta ionista. Kirjoita yhtälö uudelleen liuoksessa jo olevien ionien tunnetulla moolipitoisuudella (moolia litrassa tai M) korvaamalla tälle ionille käytetyn x: n arvo. - Esimerkiksi jos lyijyjodiyhdiste liuotettiin liuokseen, joka sisälsi 0,2 M lyijykloridia (PbCl2), voimme sitten kirjoittaa yhtälön uudestaan seuraavasti: 7,1 × 10 = (0,2 M + x) (2x). Ja sitten, koska 0,2 M on niin korkea pitoisuus kuin x, voimme kirjoittaa sen turvallisesti uudestaan seuraavasti: 7,1 × 10 = (0,2 M) (2x).
 Ratkaise yhtälö. Ratkaise x ja tiedä kuinka liukoinen yhdiste on. Liukoisuusvakion määritystavan vuoksi vastauksesi ilmaistaan liuenneen yhdisteen moolien määränä litraa vettä kohti. Saatat tarvita laskinta lopullisen vastauksen löytämiseksi.
Ratkaise yhtälö. Ratkaise x ja tiedä kuinka liukoinen yhdiste on. Liukoisuusvakion määritystavan vuoksi vastauksesi ilmaistaan liuenneen yhdisteen moolien määränä litraa vettä kohti. Saatat tarvita laskinta lopullisen vastauksen löytämiseksi. - Seuraava koskee liukoisuutta puhtaaseen veteen, ei yleisten ionien kanssa.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 moolia litrassa liukenee. Tämä on hyvin pieni määrä, joten tiedät, että tämä yhdiste on periaatteessa huonosti liukoinen.
Tarpeet
- Liukoisuustuotteiden vakioiden taulukko (K.sp) yhteyksiä varten.
Vinkkejä
- Jos sinulla on tietoja kokeista yhdisteen liukenemisasteesta, voit käyttää samaa yhtälöä ratkaisemaan liukoisuusvakio Ksp.
Varoitukset
- Näille termeille ei ole yleisesti hyväksyttyä määritelmää, mutta kemistit ovat yhtä mieltä useimmista yhdisteistä. Joitakin marginaalitapauksia yhdisteistä, joissa on merkittävä osuus liuenneita ja liukenemattomia molekyylejä, voidaan kuvata erilaisilla liukoisuustaulukoilla.
- Jotkut vanhemmat oppikirjat antavat NH: n4OH taas liukoisena koostumuksena. Tämä on väärin; pieniä määriä NH: tä4 ja OH-ioneja voidaan havaita, mutta niitä ei voida eristää yhdisteen muodostamiseksi.