Kirjoittaja:
Eugene Taylor
Luomispäivä:
12 Elokuu 2021
Päivityspäivä:
22 Kesäkuu 2024
Sisältö
- Astua
- Osa 1/2: Elementin normaali elektronikonfiguraatio
- Osa 2/2: Jalokaasuelektroni-konfiguraatio
- Varoitukset
Elektronikokoonpanon kirjoittaminen elementille on hyvä tapa tarkastella elektronien jakautumista atomissa. Elementistä riippuen kaava voi olla hyvin pitkä. Siksi tutkijat ovat kehittäneet lyhyen merkinnän, joka käyttää jalokaasua edustamaan elektroneja, jotka eivät ole valenssielektroneja. Tämä yksinkertaistaa elektronikonfiguraatiota ja helpottaa elementin kemiallisten ominaisuuksien ymmärtämistä.
Astua
Osa 1/2: Elementin normaali elektronikonfiguraatio
 Määritä elementissä läsnä olevien elektronien määrä. Elementin atominumero kertoo protonien määrän. Koska neutraalissa tilassa olevilla elementeillä on sama määrä protoneja ja elektroneja, voit käyttää myös atomilukua kuin elementillä olevien elektronien lukumäärä. Atomiluku, jonka löydät jaksollisesta taulukosta, on numero suoraan elementin symbolin yläpuolella.
Määritä elementissä läsnä olevien elektronien määrä. Elementin atominumero kertoo protonien määrän. Koska neutraalissa tilassa olevilla elementeillä on sama määrä protoneja ja elektroneja, voit käyttää myös atomilukua kuin elementillä olevien elektronien lukumäärä. Atomiluku, jonka löydät jaksollisesta taulukosta, on numero suoraan elementin symbolin yläpuolella. - Esimerkiksi natriumin symboli on Na. Na: n atomiluku on 11.
 Tieto elektronikuorista ja energiatasoista. Ensimmäisellä elektronikuorella on vain s-energiataso, toisella elektronikuorella on sekä s- että p-energiataso. Kolmannella elektronikuorella on s-, p- ja d-energiataso. Neljännellä elektronikuorella on s-, p-, d- ja f-energiataso. Elektronisäiliöitä on enemmän kuin neljä, mutta lukiokemiassa kohtaat yleensä vain neljä ensimmäistä.
Tieto elektronikuorista ja energiatasoista. Ensimmäisellä elektronikuorella on vain s-energiataso, toisella elektronikuorella on sekä s- että p-energiataso. Kolmannella elektronikuorella on s-, p- ja d-energiataso. Neljännellä elektronikuorella on s-, p-, d- ja f-energiataso. Elektronisäiliöitä on enemmän kuin neljä, mutta lukiokemiassa kohtaat yleensä vain neljä ensimmäistä. - Jokaisessa energiatasossa voi olla enintään 2 elektronia.
- Jokainen p-energiataso voi sisältää enintään 6 elektronia.
- Jokainen d energiataso voi sisältää jopa 10 elektronia.
- Jokainen f-energiataso voi sisältää jopa 14 elektronia.
 Opi elektronien täyttämisen säännöt. Aufbau-periaatteen mukaan sinun on lisättävä elektroneja alimmalle energiatasolle, ennen kuin elektroni voidaan lisätä korkeammalle energiatasolle. Jokaisella energiatasolla voi olla useita suborbitaaleja, mutta jokaiseen suborbitaaliin mahtuu enintään kaksi elektronia kerralla. S-energiatasolla on yksi suborbitaali, p: llä on 3 suborbitaalia, d: llä on 5 suborbitaalia ja f: llä on 7 suborbitaalia.
Opi elektronien täyttämisen säännöt. Aufbau-periaatteen mukaan sinun on lisättävä elektroneja alimmalle energiatasolle, ennen kuin elektroni voidaan lisätä korkeammalle energiatasolle. Jokaisella energiatasolla voi olla useita suborbitaaleja, mutta jokaiseen suborbitaaliin mahtuu enintään kaksi elektronia kerralla. S-energiatasolla on yksi suborbitaali, p: llä on 3 suborbitaalia, d: llä on 5 suborbitaalia ja f: llä on 7 suborbitaalia. - D-energiatasolla on hiukan suurempi energia kuin alemman elektronikuoren energiatasolla, joten korkeampi s-energiataso täyttyy todennäköisemmin kuin alempi d-energiataso. Elektroni-kokoonpanon kirjoittaminen tarkoittaa, että se näyttää tältä: 1s2s2p3s3p4s3d.
 Käytä diagonaalikonfiguraatiota elektronikonfiguraatioiden kirjoittamiseen. Helpoin tapa muistaa, kuinka elektronit täyttyvät, on käyttää konfigurointijärjestelmää. Tässä kirjoitat muistiin kukin kuori ja energiatasot. Piirrä diagonaaliset viivat kunkin rivin oikeasta yläkulmasta vasempaan alakulmaan. Konfigurointikaavio on seuraava:
Käytä diagonaalikonfiguraatiota elektronikonfiguraatioiden kirjoittamiseen. Helpoin tapa muistaa, kuinka elektronit täyttyvät, on käyttää konfigurointijärjestelmää. Tässä kirjoitat muistiin kukin kuori ja energiatasot. Piirrä diagonaaliset viivat kunkin rivin oikeasta yläkulmasta vasempaan alakulmaan. Konfigurointikaavio on seuraava: - 1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p - Esimerkiksi: Natriumin elektronikonfiguraatio (11 elektronia) on: 1s2s2p3s.
- 1s
 Määritä kunkin kokoonpanon viimeinen kiertorata. Tarkastelemalla jaksollista taulukkoa voit määrittää, mikä elektronikonfiguraation viimeinen alikuori ja viimeinen energiataso ovat. Määritä ensin, mihin lohkoon elementti putoaa (s, p, d tai f). Laske sitten missä rivissä elementti on. Laske lopuksi, missä sarakkeessa elementti on.
Määritä kunkin kokoonpanon viimeinen kiertorata. Tarkastelemalla jaksollista taulukkoa voit määrittää, mikä elektronikonfiguraation viimeinen alikuori ja viimeinen energiataso ovat. Määritä ensin, mihin lohkoon elementti putoaa (s, p, d tai f). Laske sitten missä rivissä elementti on. Laske lopuksi, missä sarakkeessa elementti on. - Esimerkiksi natrium on s-lohkossa, joten sen elektronikonfiguraation viimeinen kiertorata on s. Se on kolmannella rivillä ja ensimmäisessä sarakkeessa, joten viimeinen kiertorata on 3s. Tämä on hyvä tapa tarkistaa lopullinen vastauksesi.
- Sääntö on hieman erilainen d-kiertoradalla. D-lohkoelementtien ensimmäinen rivi alkaa neljännestä rivistä, mutta sinun on vähennettävä 1 rivinumerosta, koska s-tasoilla on pienempi energia kuin d-tasoilla. Esimerkiksi: vanadium päättyy kolmiulotteiseksi.
- Toinen tapa tarkistaa työsi on lisätä kaikki alaindeksit. Niiden on oltava yhtä suuri kuin elementissä olevien elektronien lukumäärä. Jos sinulla on liian vähän tai liian paljon elektroneja, sinun on harkittava työsi uudelleen ja yritettävä uudelleen.
Osa 2/2: Jalokaasuelektroni-konfiguraatio
 Määritä jalokaasuelektroni-konfiguraatio. Jalokaasuelektronikokoonpano on eräänlainen lyhyt tapa kirjoittaa elementin koko elektronikonfiguraatio. Jalokaasun lyhytkirjaa käytetään yhteenvetona elementin elektronikonfiguraatiosta samalla, kun annetaan tärkeimmät tiedot kyseisen elementin valenssielektroneista.
Määritä jalokaasuelektroni-konfiguraatio. Jalokaasuelektronikokoonpano on eräänlainen lyhyt tapa kirjoittaa elementin koko elektronikonfiguraatio. Jalokaasun lyhytkirjaa käytetään yhteenvetona elementin elektronikonfiguraatiosta samalla, kun annetaan tärkeimmät tiedot kyseisen elementin valenssielektroneista. - Jalokaasu on substituoitu edustamaan kaikkia elektroneja, jotka eivät ole valenssielektroneja.
- Jalokaasut ovat heliumia, neonia, argonia, kryptonia, ksenonia ja radonia, ja ne ovat jaksollisen taulukon viimeisessä sarakkeessa.
 Tunnista jalokaasu elementtisi ajanjaksolla. Elementin jakso on vaakasuora rivi, jossa elementti sijaitsee. Jos elementti on jaksollisen taulukon neljännellä rivillä, se on jaksolla neljä. Jalokaasu, jota käytät, on kolmannella jaksolla. Alla on luettelo jalokaasuista ja niiden ajanjaksoista:
Tunnista jalokaasu elementtisi ajanjaksolla. Elementin jakso on vaakasuora rivi, jossa elementti sijaitsee. Jos elementti on jaksollisen taulukon neljännellä rivillä, se on jaksolla neljä. Jalokaasu, jota käytät, on kolmannella jaksolla. Alla on luettelo jalokaasuista ja niiden ajanjaksoista: - 1: Helium
- 2: Neon
- 3: Argoni
- 4: Krypton
- 5: Xenon
- 6: Radon
- Esimerkiksi natrium on jaksossa 3. Käytämme jalokaasukonfiguraatioon neonia, koska se on jaksossa 2.
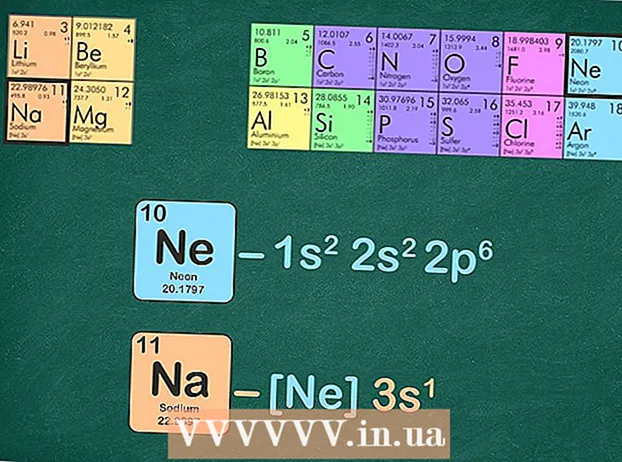
 Korvaa jalokaasu samalla määrällä elektroneja kuin jalokaasulla. Voit tehdä tämän seuraavan vaiheen muutamalla tavalla. Voit kirjoittaa jalokaasun elektronikonfiguraation ja korvata saman konfiguraation kiinnostavalla elementillä. Vaihtoehto on poistaa sama määrä elektroneja kuin jalokaasulla elementistä, jolle kirjoitat kokoonpanoa.
Korvaa jalokaasu samalla määrällä elektroneja kuin jalokaasulla. Voit tehdä tämän seuraavan vaiheen muutamalla tavalla. Voit kirjoittaa jalokaasun elektronikonfiguraation ja korvata saman konfiguraation kiinnostavalla elementillä. Vaihtoehto on poistaa sama määrä elektroneja kuin jalokaasulla elementistä, jolle kirjoitat kokoonpanoa. - Esimerkiksi natriumissa on 11 elektronia ja neonissa on 10 elektronia.
- Natriumin täydellinen elektronikonfiguraatio on: 1s22p3 ja neon on 1s22p. Kuten näette, natriumilla on 3-sekvenssejä, joita neonilla ei ole - siksi natriumin jalokaasukonfiguraatiosta tulee [Ne] 3.
- Vaihtoehtoisesti voit laskea energiatason yläindeksit, kunnes sinulla on kymmenen. Poista nämä energiatasot ja puhumattakaan jäljellä olevasta. Jos kirjoitat natriumilla elektronikonfiguraatiota neonilla, sinulle jää yksi elektroni: [Ne] 3.
Varoitukset
- Vain neutraalissa atomissa atomiluku on yhtä suuri kuin elektronien lukumäärä. Ioni sisältää eri määrän elektroneja. Jos ionilla on varaus -1, sillä on yksi ylimääräinen elektroni. Latauksella -2 on kaksi ylimääräistä elektronia jne.