Kirjoittaja:
Christy White
Luomispäivä:
8 Saattaa 2021
Päivityspäivä:
1 Heinäkuu 2024
Sisältö
- Astua
- Menetelmä 1/3: Osa 1: Elektronisäiliöiden ymmärtäminen
- Menetelmä 2/3: Osa 2: Valenssielektronien etsiminen metalleista, paitsi siirtymämetalleista
- Menetelmä 3/3: Osa 3: Valenssielektronien etsiminen siirtymämetalleista
- Vinkkejä
- Tarpeet
Valenssielektronit ovat elementin ulkokuoressa. Valenssielektronien määrä atomissa määrittää kemiallisen sidoksen tyypin, jonka tämä elementti voi muodostaa. Paras tapa selvittää valenssielektronien määrä on käyttää alkuaineiden jaksollista taulukkoa.
Astua
Menetelmä 1/3: Osa 1: Elektronisäiliöiden ymmärtäminen
 Elementtien jaksollinen taulukko. Tämä on värikooditaulukko, jossa kussakin solussa elementti näkyy atominumerona ja 1-3 kirjaimena symbolina.
Elementtien jaksollinen taulukko. Tämä on värikooditaulukko, jossa kussakin solussa elementti näkyy atominumerona ja 1-3 kirjaimena symbolina.  Etsi elementin atominumero. Atomiluku on elementin symbolin yläpuolella tai vieressä. Esimerkiksi: boorin (B) atomiluku on 5, mikä tarkoittaa, että sillä on 5 protonia ja 5 elektronia.
Etsi elementin atominumero. Atomiluku on elementin symbolin yläpuolella tai vieressä. Esimerkiksi: boorin (B) atomiluku on 5, mikä tarkoittaa, että sillä on 5 protonia ja 5 elektronia.  Piirrä yksinkertainen esitys atomista ja aseta elektronit kiertoradalle ytimen ympärille. Näitä töitä kutsutaan myös kuoriksi tai energiatasoksi. Elektronien enimmäismäärä, jotka voivat olla samassa kuoressa, on kiinteä, ja kuoret täytetään sisäpuolelta kiertoradalle.
Piirrä yksinkertainen esitys atomista ja aseta elektronit kiertoradalle ytimen ympärille. Näitä töitä kutsutaan myös kuoriksi tai energiatasoksi. Elektronien enimmäismäärä, jotka voivat olla samassa kuoressa, on kiinteä, ja kuoret täytetään sisäpuolelta kiertoradalle. - K-kuori (sisempi): enintään 2 elektronia.
- L-kuori: enintään 8 elektronia.
- M-kuori: enintään 18 elektronia.
- N kuori: enintään 32 elektronia.
- O Kuori: Enintään 50 elektronia.
- P Kuori (ulompi): enintään 72 elektronia.
 Etsi ulkokuoressa olevien elektronien määrä. Nämä ovat valenssielektroneja.
Etsi ulkokuoressa olevien elektronien määrä. Nämä ovat valenssielektroneja. - Kun valenssikuori on täynnä, elementti on vakaa.
- Jos valenssikuori ei ole täynnä, alkuaine on reaktiivinen, mikä tarkoittaa, että se voi kemiallisesti sitoutua toisen elementin atomiin. Jokainen atomi jakaa valenssielektroninsa yrittäen tehdä valenssikuoresta täyden.
Menetelmä 2/3: Osa 2: Valenssielektronien etsiminen metalleista, paitsi siirtymämetalleista
 Numeroi jokaisen jaksollisen taulukon sarake 1: stä 18: een. Vety (H) on sarakkeen 1 yläosassa ja helium (He) sarakkeen 18 yläosassa. Nämä ovat eri elementtiryhmiä.
Numeroi jokaisen jaksollisen taulukon sarake 1: stä 18: een. Vety (H) on sarakkeen 1 yläosassa ja helium (He) sarakkeen 18 yläosassa. Nämä ovat eri elementtiryhmiä.  Anna jokaiselle riville numero välillä 1–7. Nämä ovat alkuaineiden jaksoja, ja ne vastaavat atomin kuorien määrää tai energiatasoja.
Anna jokaiselle riville numero välillä 1–7. Nämä ovat alkuaineiden jaksoja, ja ne vastaavat atomin kuorien määrää tai energiatasoja. - Vety (H) ja helium (He) ovat molemmat 1 kuori, kun taas Francium (Fr) on 7.
- Lantanidit ja aktinidit on ryhmitelty ja lueteltu päätaulukon alla. Kaikki lantanidit kuuluvat jaksoon 6, ryhmään 3 ja kaikki aktinidit kuuluvat jaksoon 7, ryhmään 3.
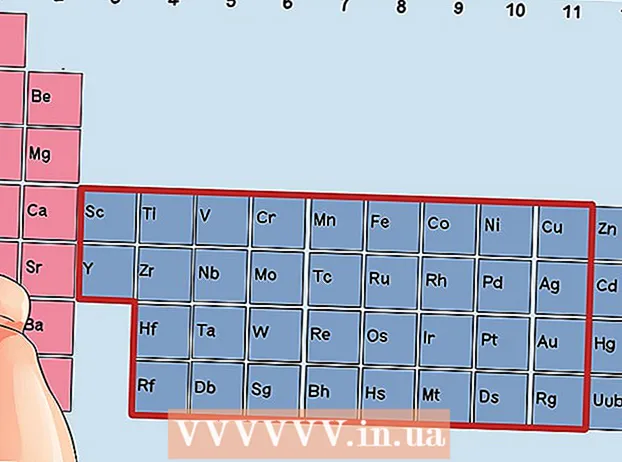
 Etsi elementti, joka ei ole siirtymämetalli. Siirtymämetallit ovat ryhmissä 3 - 12. Muiden metallien ryhmänumerot osoittavat valenssielektronien lukumäärän.
Etsi elementti, joka ei ole siirtymämetalli. Siirtymämetallit ovat ryhmissä 3 - 12. Muiden metallien ryhmänumerot osoittavat valenssielektronien lukumäärän. - Ryhmä 1: 1 valenssielektroni
- Ryhmä 2: 2 valenssielektronia
- Ryhmä 13: 3 valenssielektronia
- Ryhmä 14: 4 valenssielektronia
- Ryhmä 15: 5 valenssielektronia
- Ryhmä 16: 6 valenssielektronit
- Ryhmä 17: 7 valenssielektronia
- Ryhmä 18: 8 valenssielektronia - paitsi helium, jolla on 2
Menetelmä 3/3: Osa 3: Valenssielektronien etsiminen siirtymämetalleista
 Etsi elementti ryhmistä 3-12, siirtymämetallit.
Etsi elementti ryhmistä 3-12, siirtymämetallit. Määritä valenssielektronien määrä ryhmän numeron perusteella. Nämä ryhmänumerot vastaavat mahdollista valenssielektronien määrää.
Määritä valenssielektronien määrä ryhmän numeron perusteella. Nämä ryhmänumerot vastaavat mahdollista valenssielektronien määrää. - Ryhmä 3: 3 valenssielektronia
- Ryhmä 4: 2 - 4 valenssielektronia
- Ryhmä 5: 2 - 5 valenssielektronia
- Ryhmä 6: 2-6 valenssielektronia
- Ryhmä 7: 2 - 7 valenssielektronia
- Ryhmä 8: 2 tai 3 valenssielektronia
- Ryhmä 9: 2 tai 3 valenssielektronia
- Ryhmä 10: 2 tai 3 valenssielektronia
- Ryhmä 11: 1 tai 2 valenssielektronia
- Ryhmä 12: 2 valenssielektronia
Vinkkejä
- Siirtymämetalleilla voi olla valenssikuoria, jotka eivät ole täysin täynnä. Valenssielektronien tarkan lukumäärän määrittäminen siirtymämetalleissa vaatii tiettyjä kvanttiteorian periaatteita, jotka eivät kuulu tämän paperin piiriin.
Tarpeet
- Elementtien jaksollinen taulukko
- Lyijykynä
- Paperi