Kirjoittaja:
Helen Garcia
Luomispäivä:
21 Huhtikuu 2021
Päivityspäivä:
1 Heinäkuu 2024
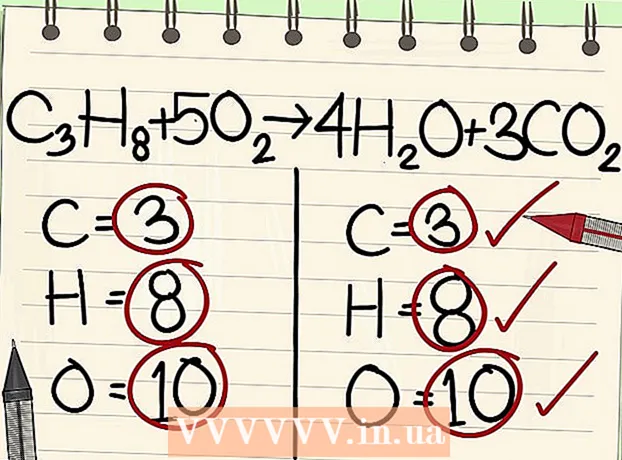
Sisältö
- Askeleet
- Menetelmä 1/2: Perinteinen menetelmä
- Menetelmä 2/2: Algebrallinen menetelmä
- Vinkkejä
- Varoitukset
Kemiallinen yhtälö on symbolinen esitys kemiallisesta reaktiosta. Tässä tapauksessa reagoivat yhdisteet (reagenssit) on kirjoitettu vasemmalle ja tuloksena olevat aineet (reaktiotuotteet) - yhtälön oikealle puolelle. Niiden väliin asetetaan nuoli vasemmalta oikealle, mikä osoittaa reaktion suunnan. Massan säilymisen lain mukaan kemiallisen reaktion aikana uusia atomeja ei voi syntyä tai vanhoja katoaa, joten reaktanttien atomien määrän on oltava yhtä suuri kuin atomien lukumäärä kemiallisen reaktion tuotteissa . Tässä artikkelissa kuvataan kuinka tasapainottaa kemialliset yhtälöt eri menetelmillä.
Askeleet
Menetelmä 1/2: Perinteinen menetelmä
 1 Kirjoita kemiallinen yhtälö. Harkitse esimerkiksi seuraavaa reaktiota:
1 Kirjoita kemiallinen yhtälö. Harkitse esimerkiksi seuraavaa reaktiota: - C3H8 + O2 -> H.2O + CO2
- Tämä reaktio kuvaa propaanin palamista (C.3H8) hapen läsnä ollessa muodostaen vettä ja hiilidioksidia (hiilidioksidia).
 2 Kirjoita muistiin kunkin elementin atomien lukumäärä. Tee tämä yhtälön molemmille puolille. Huomaa jokaisen elementin vieressä olevat alaindeksit atomien kokonaismäärän määrittämiseksi. Kirjoita muistiin kunkin yhtälön elementin symboli ja merkitse vastaava määrä atomeja.
2 Kirjoita muistiin kunkin elementin atomien lukumäärä. Tee tämä yhtälön molemmille puolille. Huomaa jokaisen elementin vieressä olevat alaindeksit atomien kokonaismäärän määrittämiseksi. Kirjoita muistiin kunkin yhtälön elementin symboli ja merkitse vastaava määrä atomeja. - Esimerkiksi tarkasteltavan yhtälön oikealle puolelle saadaan lisäyksen seurauksena 3 happiatomia.
- Vasemmalla puolella on 3 hiiliatomia (C.3), 8 vetyatomia (H8) ja 2 happiatomia (O2).
- Oikealla puolella on 1 hiiliatomi (C), 2 vetyatomia (H2) ja 3 happiatomia (O + O2).
 3 Säästä vetyä ja happea myöhempää käyttöä varten, koska ne ovat osa useita yhdisteitä vasemmalla ja oikealla puolella. Vety ja happi ovat osa useita molekyylejä, joten on parasta tasapainottaa ne viimeisenä.
3 Säästä vetyä ja happea myöhempää käyttöä varten, koska ne ovat osa useita yhdisteitä vasemmalla ja oikealla puolella. Vety ja happi ovat osa useita molekyylejä, joten on parasta tasapainottaa ne viimeisenä. - Ennen vedyn ja hapen tasapainottamista sinun on laskettava atomit uudelleen, koska muita tekijöitä voidaan tarvita muiden alkuaineiden tasapainottamiseksi.
 4 Aloita harvemmin tavaroista. Jos haluat tasapainottaa useita alkuaineita, valitse yksi, joka on osa yhtä reagenssi- ja yhtä reaktiotuotemolekyyliä. Joten hiili on ensin tasapainotettava.
4 Aloita harvemmin tavaroista. Jos haluat tasapainottaa useita alkuaineita, valitse yksi, joka on osa yhtä reagenssi- ja yhtä reaktiotuotemolekyyliä. Joten hiili on ensin tasapainotettava.  5 Tasapainon lisäämiseksi kerroin yhden hiiliatomin eteen. Aseta kerroin yhden hiilen eteen yhtälön oikealle puolelle tasapainottaaksesi sen 3 hiilellä vasemmalla puolella.
5 Tasapainon lisäämiseksi kerroin yhden hiiliatomin eteen. Aseta kerroin yhden hiilen eteen yhtälön oikealle puolelle tasapainottaaksesi sen 3 hiilellä vasemmalla puolella. - C3H8 + O2 -> H.2O + 3CO2
- Kerroin 3 hiilen edessä yhtälön oikealla puolella osoittaa, että hiiliatomeja on kolme, jotka vastaavat vasemmalla puolella olevan propaanimolekyylin kolmea hiiliatomia.
- Kemiallisessa yhtälössä voit muuttaa kertoimia atomien ja molekyylien edessä, mutta alaindeksien on pysyttävä muuttumattomina.
 6 Sitten tasapainotetaan vetyatomeja. Kun tasoitit hiiliatomien määrän vasemmalla ja oikealla puolella, vety ja happi pysyivät epätasapainossa. Yhtälön vasen puoli sisältää 8 vetyatomia, saman määrän pitäisi olla oikealla. Saavuta tämä suhteella.
6 Sitten tasapainotetaan vetyatomeja. Kun tasoitit hiiliatomien määrän vasemmalla ja oikealla puolella, vety ja happi pysyivät epätasapainossa. Yhtälön vasen puoli sisältää 8 vetyatomia, saman määrän pitäisi olla oikealla. Saavuta tämä suhteella. - C3H8 + O2 -> 4H2O + 3CO2
- Olemme lisänneet kerroimen 4 oikealle, koska alaindeksi osoittaa, että meillä on jo kaksi vetyatomia.
- Jos kerrot kertoimen 4 alaindeksillä 2, saat 8.
- Tämän seurauksena saadaan 10 happiatomia oikealle puolelle: 3x2 = 6 atomia kolmessa 3CO -molekyylissä2 ja neljä muuta atomia neljässä vesimolekyylissä.
 7 Tasapainota happiatomit. Muista ottaa huomioon kertoimet, joita käytit muiden atomien tasapainottamiseen. Koska lisäsit kertoimet yhtälön oikealla puolella olevien molekyylien eteen, happiatomien määrä muuttui. Sinulla on nyt 4 happiatomia vesimolekyyleissä ja 6 happiatomia hiilidioksidimolekyyleissä. Oikealla puolella on siis 10 happiatomia.
7 Tasapainota happiatomit. Muista ottaa huomioon kertoimet, joita käytit muiden atomien tasapainottamiseen. Koska lisäsit kertoimet yhtälön oikealla puolella olevien molekyylien eteen, happiatomien määrä muuttui. Sinulla on nyt 4 happiatomia vesimolekyyleissä ja 6 happiatomia hiilidioksidimolekyyleissä. Oikealla puolella on siis 10 happiatomia. - Lisää kerroin 5 happimolekyyliin yhtälön vasemmalla puolella. Jokainen kappale sisältää nyt 10 happiatomia.
- C3H8 + 5O2 -> 4H2O + 3CO2.

- Joten yhtälön molemmat puolet sisältävät saman määrän hiili-, vety- ja happiatomeja. Yhtälö on tasapainossa.
Menetelmä 2/2: Algebrallinen menetelmä
- 1 Kirjoita reaktioyhtälö ylös. Harkitse esimerkiksi seuraavaa kemiallista reaktiota:
- PCl5 + H2O -> H.3PO4 + HCl
- 2 Laita kirjain jokaisen yhteyden eteen:
- aPCl5 + bH2O -> cH3PO4 + dHCl
- 3 Tasaa atomien määrä kullekin elementille yhtälön vasemmalla ja oikealla puolella.
- aPCl5 + bH2O -> cH3PO4 + dHCl
- Vasemmalla meillä on 2b vetyatomeja (2 kussakin H: ssa)2O), kun taas oikealla on 3c+d vetyatomeja (3 kutakin H: ta3PO4 ja 1 kussakin HCl -molekyylissä). Koska vasemmalla ja oikealla puolella on oltava sama määrä vetyatomeja, 2b pitäisi olla 3c+d.
- Tee tämä kaikille elementeille:
- P: a=c
- Cl: 5a=d
- H: 2b=3c+d
- 4 Ratkaise yhtälöjärjestelmä löytääksesi kertoimien numeeriset arvot. Järjestelmässä on useita ratkaisuja, koska muuttujia on enemmän kuin yhtälöitä. Tällainen ratkaisu on löydettävä, jotta kaikki kertoimet olisivat mahdollisimman pieniä kokonaislukuja.
- Voit ratkaista yhtälöjärjestelmän nopeasti määrittämällä numeerisen arvon yhdelle muuttujasta. Oletetaan, että a = 1. Ratkaistaan järjestelmä ja löydetään jäljellä olevien muuttujien arvot:
- Jos P a = c, niin c = 1
- Cl 5a = d, joten d = 5
- Koska H 2b = 3c + d, löydämme arvon b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4
- Meillä on siis seuraavat kertoimet:
- a = 1
- b = 4
- c = 1
- d = 5
Vinkkejä
- Jos sinulla on vaikeuksia, online -laskinta voidaan käyttää kemiallisten yhtälöiden tasapainottamiseen. Huomaa kuitenkin, että tällaista laskinta ei saa käyttää tentin aikana, joten älä luota pelkästään siihen.
- Muista, että joskus yhtälöä voidaan yksinkertaistaa! Jos kaikki kertoimet ovat jaettavissa kokonaisluvulla, yksinkertaista yhtälö.
Varoitukset
- Päästäksesi eroon murto -kertoimista kertomalla koko yhtälö (sen vasen ja oikea puoli) murtoluvun nimittäjällä.
- Älä koskaan käytä murto -osia kemiallisen yhtälön kertoimina - kemiallisissa reaktioissa ei ole puolimolekyylejä tai atomeja.
- Tasapainotusprosessissa voit käyttää murto -osia mukavuuden vuoksi, mutta yhtälö ei ole tasapainossa niin kauan kuin siinä on murto -kertoimia.