Kirjoittaja:
Louise Ward
Luomispäivä:
11 Helmikuu 2021
Päivityspäivä:
1 Heinäkuu 2024

Sisältö
Atomin koko on niin pieni, että kemiallisen yhdisteen atomimäärää on vaikea mitata tarkasti. Aineiden määrän tarkka mittaamiseksi tutkijat käyttävät moolia yksikköä edustamaan tiettyä määrää atomeja. Yksi mooli ainetta määritellään vastaavaksi hiiliatomien lukumäärälle 12 grammassa 12 hiili-isotooppia, joka on noin 6022 x 10 atomia. Tätä arvoa kutsutaan Avogadro-luvuksi tai Avogadron vakiona. Tätä kutsutaan myös atomien lukumääräksi 1 moolissa mitä tahansa alkuaineita, ja 1 moolia aineen massaa kutsutaan kyseisen aineen moolimassaksi.
Askeleet
Menetelmä 1/2: Laske alkuaineen moolimassa
Moolimassan määritelmä. Aineen moolimassa on aineen yhden moolin massa (grammoina). Elementin moolimassa lasketaan kertomalla sen atomimassa muuntokertoimella gramma / mol (g / mol).
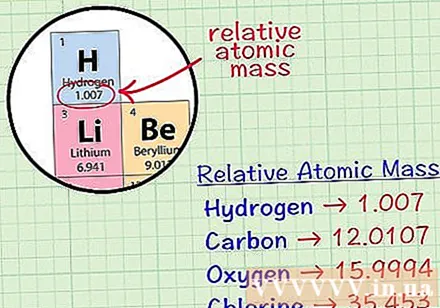
Etsi elementin keskimääräinen kuutiometri. Elementin keskimääräinen massatomi on keskimääräinen massa atomiyksiköinä näytteessä, joka sisältää kaikki kyseisen elementin isotoopit. Nämä tiedot annetaan yleensä jaksollisessa elementtitaulukossa. Paikantamalla elementti, voit löytää keskimääräisen kuutioatomin, joka on kirjoitettu juuri elementin kemiallisen symbolin alle. Tämä arvo ei ole kokonaisluku, vaan desimaalilukuinen luku.- Esimerkiksi vedyllä keskimääräinen massatomi on 1,007; Hiilen keskimääräinen kuutiometri on 12107; Hapen keskimääräinen massatomi on 159994; kloorin keskimääräinen atomimassa on 35 453.

Kerro keskimääräinen massatomi moolimassavakiona. Molaarisen liukun yksikkö määritellään 0,001 kilogrammaksi mooliksi tai 1 grammaksi moolia kohti. Keskimääräisen massatomin ja moolimassavakion tulo muuntaa atomimassayksikön grammoiksi moolia kohti, joten vedyn moolimassa on 1,007 grammaa moolia kohti, hiilen osalta se on 12. , 0107 grammaa moolia kohden, happea on 15,9995 grammaa moolia kohden ja klooria 35 453 grammaa moolia kohden.- Jotkut alkuaineet ovat luonnossa molekyyleinä, jotka koostuvat kahdesta tai useammasta samasta atomista. Toisin sanoen, jos haluat laskea yhdisteiden moolimassa, joka koostuu useammasta kuin yhdestä atomista, kuten vetykaasusta, happikaasusta tai kloorikaasusta, sinun on määritettävä yhdisteen keskimääräinen atomimassa ja kerrottava tämä arvo. moolimassavakion avulla '' sitten '' kerro juuri löytämäsi tuote 2: lla.
- H: n kanssa2: 1007 x 2 = 2 014 grammaa moolia kohti; O: lle2: 15,9994 x 2 = 31,9988 grammaa moolia kohti; ja Cl2: 35 453 x 2 = 70,096 grammaa / mol.
Menetelmä 2/2: Laske yhdisteen moolimassa

Määritä yhdisteen rakennekaava. Aineen rakennekaava antaa jokaisen yhdisteen muodostavan elementin atomiluvun. (Nämä tiedot ovat saatavilla kaikissa viitekirjoissa). Esimerkiksi kloorivetyhapon kemiallinen kaava on HCI; glukoosista on C6H12O6. Tällä rakennekaavalla voimme määrittää kunkin atomityypin lukumäärän, joka muodostaa tarkasteltavan yhdisteen.- Jossa HCl: ssä on yksi vetyatomi ja yksi klooriatomi.
- Glukoosisokerimolekyyli C6H12O6 on 6 hiiliatomia, 12 vetyatomia ja 6 happiatomia.
Määritä kunkin elementin keskimääräinen massatomi. Käytä jaksollista taulukkoa löytääksesi jokaisen yhdisteessä olevan elementin keskimääräisen massatomin. Keskimääräinen massatomi kirjoitetaan yleensä jaksollisen järjestelmän alkuaineen kemiallisen symbolin alle. Samoin kuin elementin moolimassa lasketaan, kerro keskimääräinen massatomi 1 grammalla / mol.
- Suolahapon muodostavien alkuaineiden keskimääräinen massatomi on seuraava: vety 1007 g / mol ja kloori 35,453 g / mol.
- Glukoosimolekyylin muodostavien alkuaineiden keskimääräinen massatomi on: hiili, 12 017 g / mol; vety, 1007 g / mol; ja happi, 15,9995 g / mol.
Laske kunkin komponentin moolimassa. Kertomalla alkuaineen massatomi yhdisteen sisältämien atomien lukumäärällä saadaan elementin keskimääräinen massa yhdisteessä.
- Kloorivetyhapon, HCl: n tapauksessa vetyelementin moolimassa on 1007 g / mol ja kloorin 35,453 g / mol.
- Glukoosin tapauksessa C6H12O6, kunkin alkuaineen moolimassa on seuraava: hiili, 12,0107 x 6 = 72,0642 g / mol; vety, 1007 x 12 = 12,084 g / mol; happi, 159995 x 6 = 95,9964 g / mol.
Aineosien kokonaismoolimassa. Kompostointielementtien kokonaismoolimassa on yhdisteen moolimassa.Edellisessä vaiheessa laskimme jokaisen yhdisteessä olevan elementin moolimassa, tässä vaiheessa meidän on vain lisättävä kaikki nämä arvot yhteen.
- Suolahapon moolimassa on 1 007 + 35 453 = 36 460 g / mol. 36,46 grammaa on 1 mol suolahapon massa.
- Glukoosin moolimassa on 72,0642 + 12,084 + 95,9964 = 180 1446 g / mol. Joten jokaisen glukoosimoolin massa on 180,14 grammaa.
Neuvoja
- Vaikka useimmissa tapauksissa keskimääräinen massatomi kirjataan 1 000: n tarkkuudella (4 desimaalia), laboratorioissa moolimassa pienenee usein kahteen desimaaliin, joskus jopa vähemmän suurille molekyyleille. Siksi laboratoriotapauksessa suolahapon moolimassa voidaan kirjoittaa muodossa 36,46 grammaa / mol, glukoosille 180,14 grammaa / mol.
Mitä tarvitset
- Kemiallinen viitekirja tai jaksollinen alkuaineiden taulukko
- Tietokone